“是时候重新思考在免疫治疗时保留淋巴结的重要性了!”[1]
研究成果在《细胞》发表之后,加州大学旧金山分校免疫学家Matthew H. Spitzer如是说。
近日,由Spitzer领衔的研究团队,首次基于临床试验,深入研究了免疫治疗对淋巴结中不同T细胞亚型的影响[2]。
他们基于患者淋巴结、血液和肿瘤微环境中CD8阳性T细胞的动态变化,提出癌症患者在接受免疫治疗之后,在没有被癌细胞入侵的淋巴结中,耗竭T细胞前体细胞(Tpex)会分化成过渡性中间耗竭T细胞(Tex-int);随后,Tex-int大量进入血液系统、扩增,并浸润肿瘤。
Spitzer认为,在免疫治疗前保持淋巴结的完整,或许可以提高免疫治疗的效果。这也意味着,癌症免疫新辅助治疗又添重磅支持证据。
论文首页截图
癌症免疫治疗仍有许多未解之谜,响应免疫治疗的T细胞来源就是其中之一。
在最开始的时候,肿瘤中的耗竭T细胞被认为是响应免疫治疗的关键。然而,后来大量的研究表明,响应免疫治疗的T细胞其实是免疫治疗后从外周血进入肿瘤的,而不是肿瘤中原本存在的T细胞[3]。
关于血液中响应免疫治疗T细胞的来历,基于小鼠的研究表明指向了引流淋巴结[4]。然而,在Spitzer团队启动这个研究的时候,淋巴结与人类免疫治疗效果之间的关系仍不明确,小鼠的研究到底能否反应人体的情况也未可知。
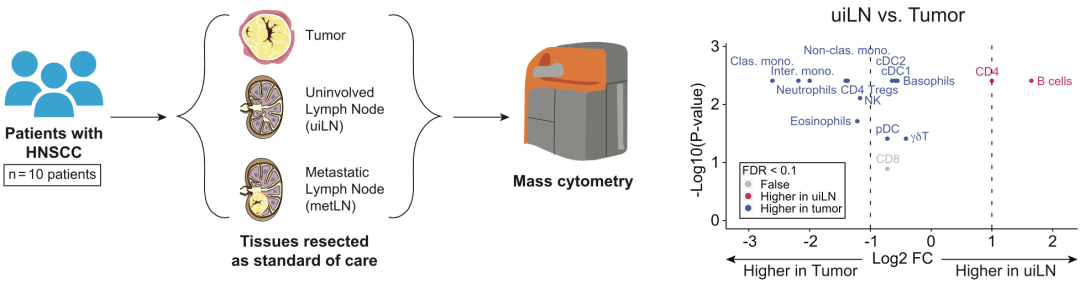
为了搞清楚这个问题,Spitzer团队还启动了局部转移性头颈部鳞状细胞癌(HNSCC)术前免疫治疗(PD-L1抑制剂阿替利珠单抗)的临床研究(NCT03708224)。在临床治疗过程中,Spitzer团队采集了大量的样本,包括肿瘤组织及匹配的未转移局部淋巴结(uiLNs)和/或存在转移的局部淋巴结(metLNs),以及治疗前后不同时间段的血液样本。作为对照,他们还采集了未接受免疫治疗患者(22人)的各种样本。
Spitzer团队首先使用质谱流式细胞术,分析了肿瘤组织和对应淋巴结中主要免疫细胞亚群。总的来看,CD4阳性T细胞和B细胞在uiLNs中占比更高,而其他免疫细胞亚群在肿瘤中占比更高;不过,CD8阳性T细胞在两种组织中占比相似。
研究方法及主要结果
通过对CD8阳性T的聚类分析,他们还发现HNSCC患者的uiLNs含有更多的CD8阳性Tpex细胞,而Tex-int在肿瘤中的频率更高。
结合之前的研究数据,他们认为,这些结果表明淋巴结中的Tpex可能在人类对免疫治疗的反应中发挥重要作用。事实也确实如此,因为他们发现淋巴结中的Tpex与肿瘤中的Tex存在克隆关系。
那uiLNs中的Tpex究竟是如何响应免疫检查点抑制剂的治疗的呢?
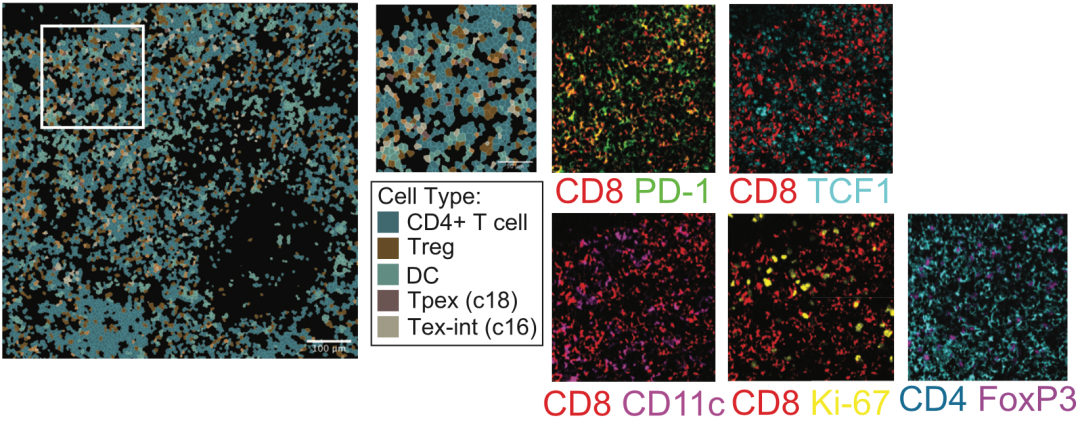
通过与没有接受阿替利珠单抗治疗的uiLNs相比,接受治疗的患者uiLNs中Tpex水平下降,但是Tex-int的水平却大幅上升。而且,在免疫治疗之后,这两种CD8阳性T细胞亚型围绕在树突状细胞(DC)周围的频率提高了、且PD-1的表达水平也提高了,而DC细胞的频率并没有发生变化。
基于以上观察,Spitzer团队认为,Tpex的减少和Tex-int增加,可能是免疫治疗导致Tpex分化成Tex-int;此外,考虑到Tpex和Tex-int更多定位于DCs附近,并伴随PD-1表达升高,表明这两种细胞被激活,且uiLNs中的DCs在介导抗肿瘤CD8阳性T细胞反应中发挥重要作用。
多重离子束成像显示的免疫细胞变化
考虑到之前的很多研究都表明,血液中CD8阳性T细胞的扩增与肿瘤对免疫治疗有反应相关[6,7]。因此Spitzer团队也分析了治疗前后患者血液中T细胞的变化。
分析结果显示,免疫治疗后血液和肿瘤组织中的Tpex水平都极低,这再次证实uiLNs中的Tpex减少,不是因为流出淋巴结,而是分化成Tex-int了。与之相反的是,免疫治疗后血液中的Tex-int不仅水平显著增加,而且还高表达增殖标志物Ki-67。
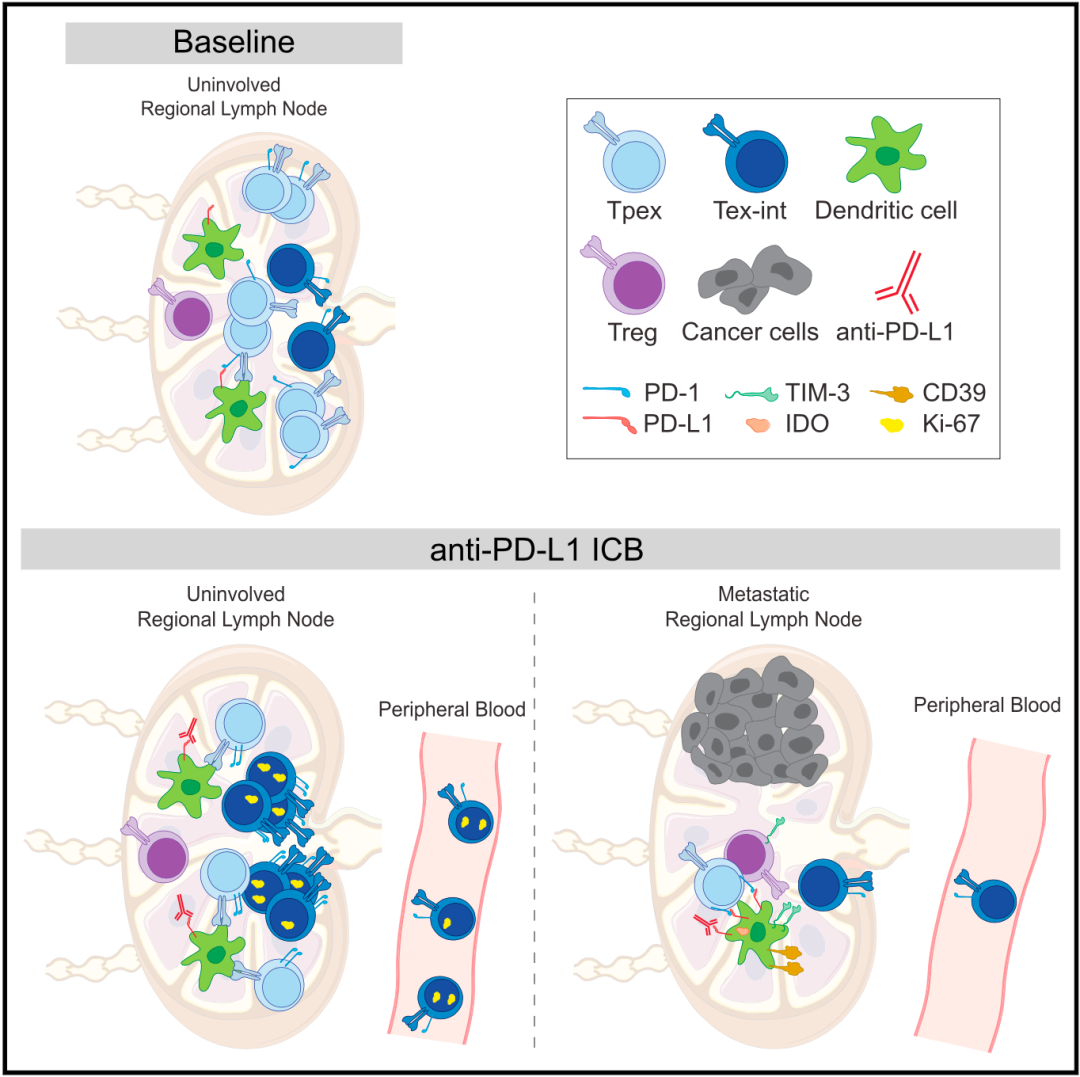
结合前面的研究数据不难看出,免疫治疗后肿瘤中Tex-int频率的增加,与治疗后uiLN中Tpex的减少和Tex-int的增加之间存在因果关系。也就是说,免疫治疗后uiLN中Tpex分化为Tex-int,Tex-int进入血液并增殖,最终浸润肿瘤。所以说,之前在临床研究中观察到的外周血T细胞扩增,源头确实是在淋巴结。
让人略感遗憾的是,Spitzer团队还发现,在存在癌细胞转移的局部淋巴结(metLNs)中,上述免疫调节过程被削弱了,好在并没有完全消失。
机制示意图
总的来说,Spitzer团队这项基于临床试验的研究成果,阐明了免疫治疗后淋巴结、血液和肿瘤中免疫细胞的动态变化,突出了淋巴结对免疫治疗的重要性。
实际上,早在去年10月份,由我国第三军医大学叶丽林、许力凡,中山大学中山医学院唐忠辉和南京大学鼓楼医院孙倍成领衔的研究团队,在《细胞》也发表了一项类似的研究成果[8]。
这个研究先基于小鼠模型实验,在肿瘤引流淋巴结中发现了具有强大的抗肿瘤能力,且真正响应PD-1/PD-L1抑制剂的CD8阳性T细胞亚群——TCF-1阳性TOX阴性肿瘤特异性记忆CD8阳性T细胞(TTSM),并在肝癌患者的引流淋巴结中发现了这一细胞亚群的存在。
也就是最近,约翰·霍普金斯大学医学院团队,发布了迄今随访时间最长的免疫新辅助治疗研究数据,发现接受PD-1抑制剂单药治疗的肺癌患者,5年总生存率高达80%,5年无复发生存率也达到60%[9]。这一结果可以说是振奋人心!
总之,这两个发表在《细胞》上的重磅研究成果,强有力地支持了免疫新辅助在早期癌症治疗中的应用。
免疫新辅助,未来可期!
参考文献:
[1].https://www.ucsf.edu/news/2023/03/424996/lymph-nodes-intact-cancer-immunotherapy
[2].Rahim MK, Okholm TLH, Jones KB, et al. Dynamic CD8+ T cell responses to cancer immunotherapy in human regional lymph nodes are disrupted in metastatic lymph nodes. Cell. 2023;186(6):1127-1143.e18. doi:10.1016/j.cell.2023.02.021
[3].Yost KE, Satpathy AT, Wells DK, et al. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nat Med. 2019;25(8):1251-1259. doi:10.1038/s41591-019-0522-3
[4].Schenkel JM, Herbst RH, Canner D, et al. Conventional type I dendritic cells maintain a reservoir of proliferative tumor-antigen specific TCF-1+ CD8+ T cells in tumor-draining lymph nodes. Immunity. 2021;54(10):2338-2353.e6. doi:10.1016/j.immuni.2021.08.026
[6].Wu TD, Madireddi S, de Almeida PE, et al. Peripheral T cell expansion predicts tumour infiltration and clinical response. Nature. 2020;579(7798):274-278. doi:10.1038/s41586-020-2056-8
[7].Luoma AM, Suo S, Wang Y, et al. Tissue-resident memory and circulating T cells are early responders to pre-surgical cancer immunotherapy. Cell. 2022;185(16):2918-2935.e29. doi:10.1016/j.cell.2022.06.018
[8].Huang Q, Wu X, Wang Z, et al. The primordial differentiation of tumor-specific memory CD8+ T cells as bona fide responders to PD-1/PD-L1 blockade in draining lymph nodes. Cell. 2022;185(22):4049-4066.e25. doi:10.1016/j.cell.2022.09.020
[9].Rosner S, Reuss JE, Zahurak M, et al. Five-Year Clinical Outcomes after Neoadjuvant Nivolumab in Resectable Non-Small Cell Lung Cancer. Clin Cancer Res. 2023;29(4):705-710. doi:10.1158/1078-0432.CCR-22-2994
文章来源:奇点网