自1975年诞生以来[1],单克隆抗体技术让人类掌握了来自免疫系统的神奇力量,癌症等多种疾病的治疗范式被彻底改写。
无论是面对病原物,还是癌细胞,单克隆抗体与抗原的高亲和力结合是治病的基础。因此,在过去的几十年里,高亲和力结合被开发治疗性抗体的研究人员奉为圭臬[2]。
然而,这个固有观念要被打破了!
近日,由南安普顿大学医学院Mark S. Cragg领衔的研究团队,在顶级期刊《自然》上发表了一项重磅研究成果[3],让我们对抗体亲和力与抗肿瘤活性之间的关系,有了全新的认知。论文的第一作者是目前在西湖大学生命科学学院担任研究员的俞晓杰博士。
这项开创性的研究发现,激动型免疫调节抗体的亲和力与激动活性之间不是正相关关系,而是呈“钟型”关系。也就是说,在一定范围内,抗体的亲和力升高,它的激动活性也会升高;超过临界值之后,随着亲和力的升高,抗体的激动活性竟然会下降。
简单地说,激动型免疫调节抗体的亲和力不是越高越好。这个发现意味着,我们需要重新审视免疫调节抗体的开发理念了!
论文首页截图
亲历免疫治疗崛起和新冠疫情大爆发的我们,对抗体一定不陌生了。
以抗PD-1抗体为代表的免疫检查点抑制剂,成为与手术、化疗和放疗并驾齐驱的癌症疗法第四极。免疫检查点抑制剂属于信号阻断型抗体,已经有研究表明,这类抗体的亲和力越高,阻断效果越好[4]。针对病原物的抗体也有类似的趋势,抗体的亲和力越高,中和病毒的效果越好[5]。
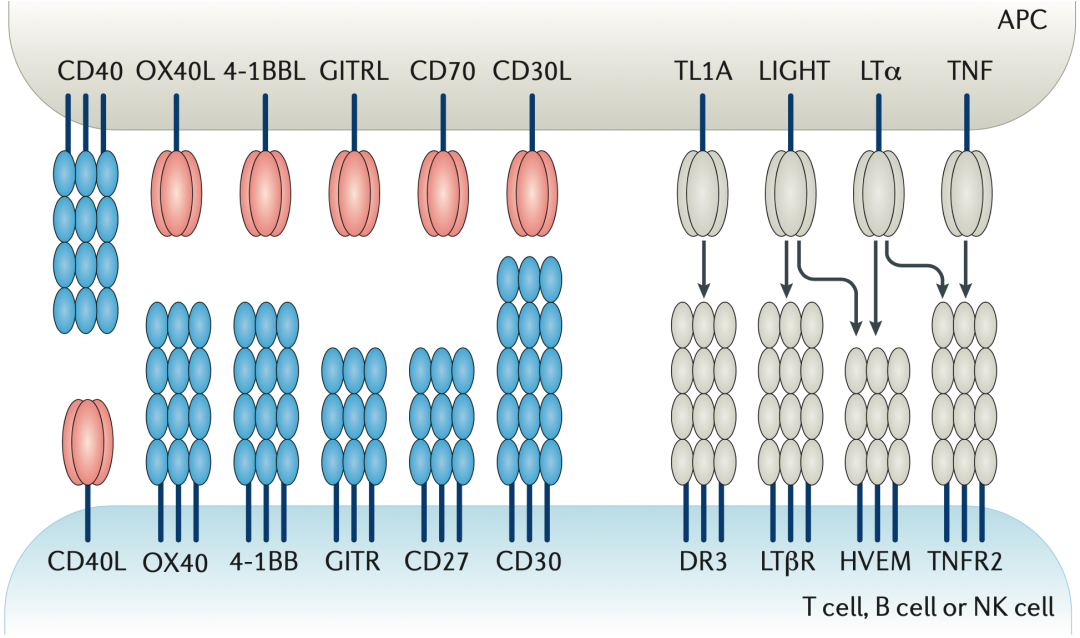
不过,在癌症免疫治疗领域,除了抑制型抗体之外,直接激活免疫的激动型抗体也是一大研究方向[6],例如肿瘤坏死因子受体(TNFR)家族的CD40和4-1BB[6]。激动型免疫调节抗体与这些共刺激信号受体结合之后,或增强或激活人体免疫反应。目前这种类型的抗体,至少有数十种处于临床开发阶段。
TNFR家族的共刺激受体[6]
遗憾的是,与抗PD-1抗体等抑制型免疫调节抗体不同,目前还没有研究探索激动型免疫调节抗体的亲和力如何影响其活力,高亲和力是否同样重要也不得而知。
为了填补上这块空白,俞晓杰博士以CD40作为主要研究对象,再辅以4-1BB和PD-1的相关研究,探索亲和力对激动型免疫调节抗体活性的影响。
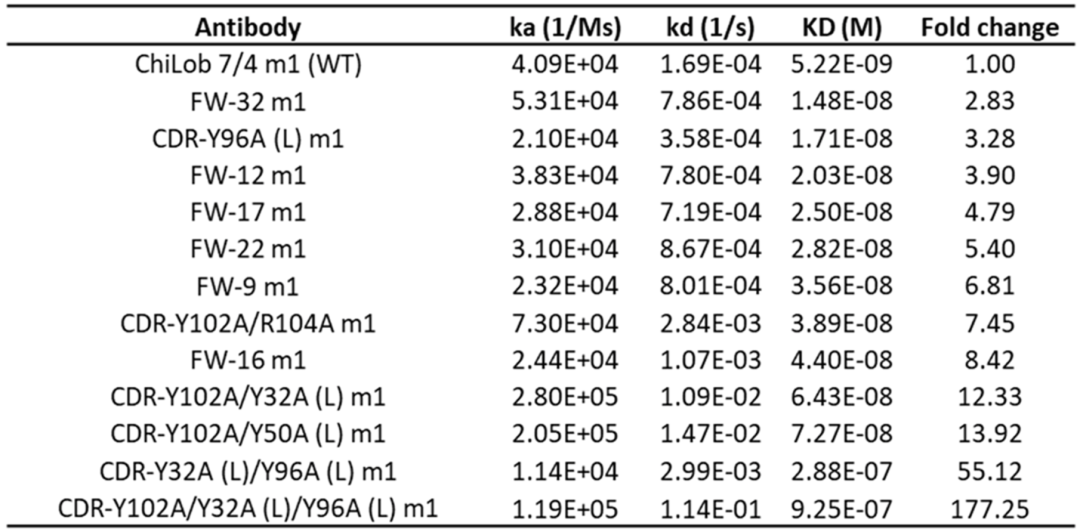
CD40抗体他们选择的是处于临床研究阶段的ChiLob 7/4。在ChiLob 7/4的基础上,他们又设计了12个ChiLob 7/4的突变体,并证明这些突变体与CD40的结合表位与野生型ChiLob 7/4相同,这就排除了结合表位差异对抗体激动活性的影响。
随后,他们检测了所有抗体与CD40的亲和力,发现它们的解离常数(KD,数值越小亲和力越强)在5.22到925nM之间,其中ChiLob 7/4的解离常数是最小的5.22nM(也就是说它的亲和力最强)。
所有抗体与CD40的亲和力比较
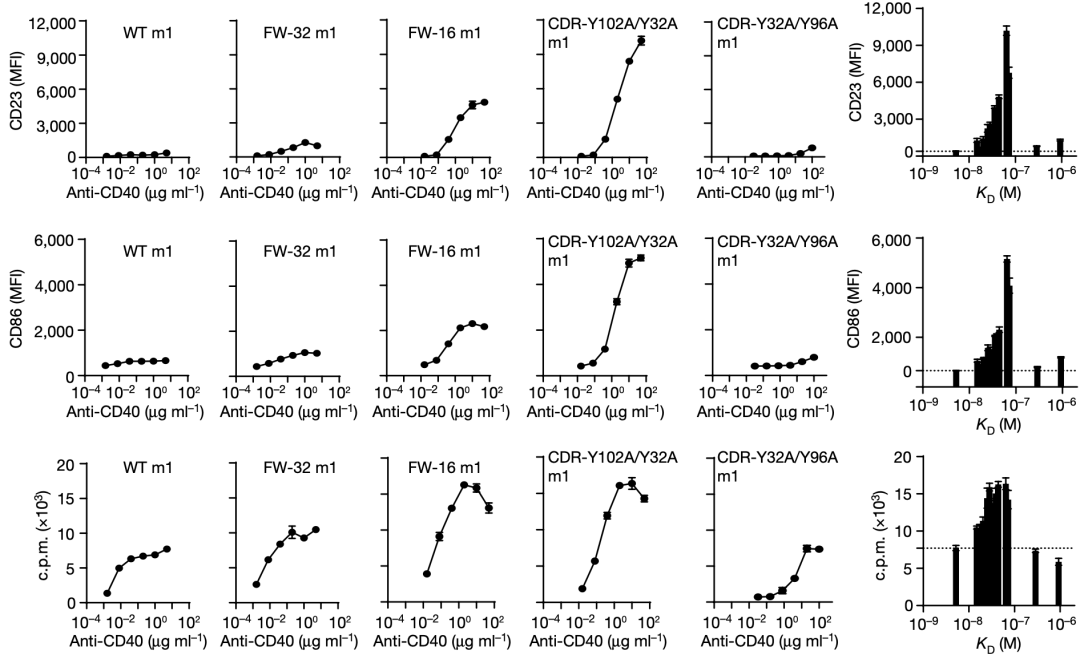
接下来俞晓杰博士以表达CD40的B细胞为研究对象,通过B细胞活化标志物CD23/CD86的水平评估B细胞的活化和增殖情况。
研究结果出人意料。
与抑制型抗体不同,与CD40亲和力低的突变体竟然表现出了更强的激动活性。确切的来说,那是一个钟型曲线。
从数据上看,最具激动性的突变体FW-16(KD值从小到大排第9)和CDR-Y102A/Y32A(KD值从小到大排第10)诱导的CD23/CD86表达,分别比野生型ChiLob 7/4高约26倍和8倍;在B细胞增殖方面,激动性和亲和力之间也出现了同样的钟形曲线,激动性最强的突变体诱导的增殖量高出2倍。
不同突变体的激动活性比较
体内研究结果与体外保持一致,低亲和力突变体诱导了更高水平的抗原特异性CD8阳性T细胞扩增,其中最具激动性的突变体FW-16诱导的扩增比ChiLob 7/4高8倍。
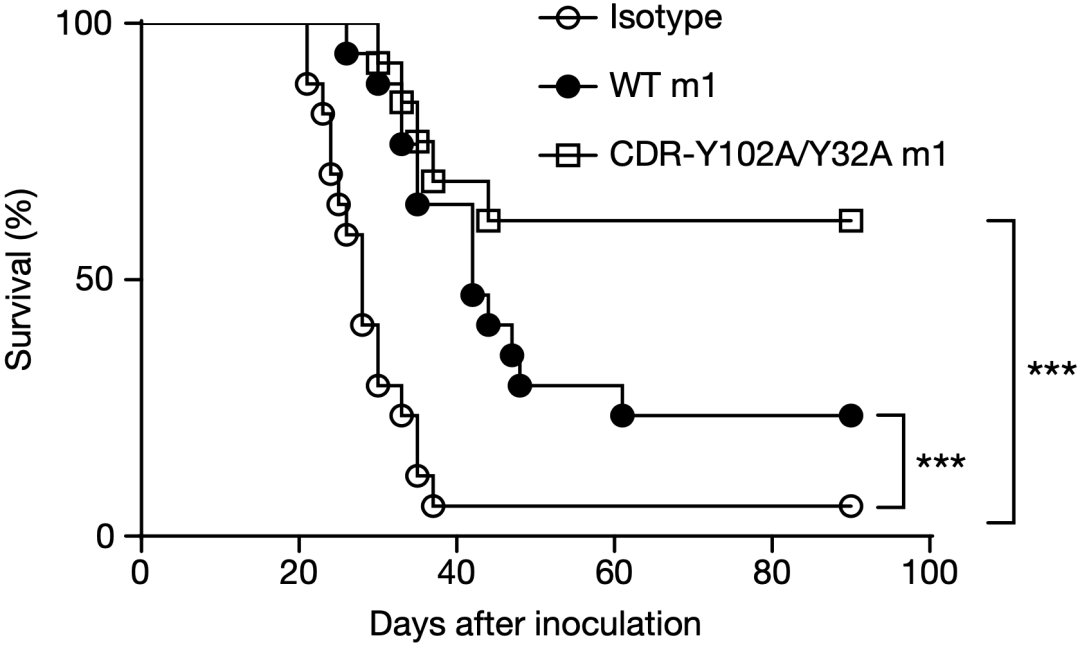
低亲和力突变体诱导的肿瘤特异性T细胞反应,在肿瘤小鼠模型上发挥了更强大的抗肿瘤免疫反应。与具有最高亲和力的ChiLob 7/4相比,低亲和力突变体CDR-Y102A/Y32A能让更多小鼠存活下来。
这些数据说明,低亲和力抗CD40抗体在体外和体内都具备强大的激动活性,并且与高亲和力的ChiLob 7/4相比表现出更强大的抗肿瘤活性。
抗肿瘤活性的比较
在人类研究系统中,俞晓杰博士也证实了低亲和力抗体的激动活性更强。
那么问题就来了:为什么激动型免疫调节抗体的表现如此另类?背后的机制究竟是什么?
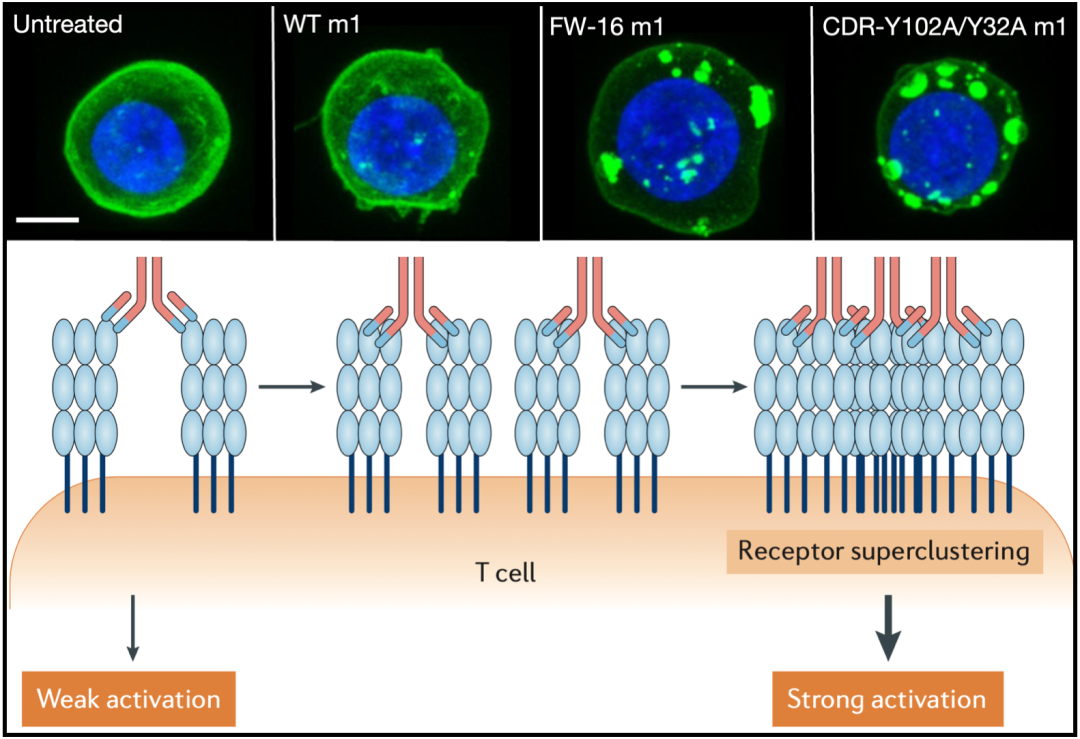
为了破解这个谜题,俞晓杰博士做了大量的研究,最后发现原来与高亲和力抗体相比,低亲和力抗体能诱导更高水平的CD40受体聚集。
CD40的聚集为何显得那么重要呢?原来抗体的激动作用就是受TNFR家族这些受体的聚集调节的,聚集一起的CD40越多,信号越强。更重要的是,这个过程不依赖于抗体Fc段的受体FcγR。荧光显微镜观察到的现象,也证实了上述发现。
荧光显微镜照片(上)和机制示意图(下)
围绕4-1BB的研究重现了CD40的研究结果,这说明对TNFR家族的抗体而言,低亲和力诱导的强激动活性是保守的。
在TNFR家族之外的PD-1的研究中,俞晓杰博士也观察到了类似的现象,高亲和力的PD-1抑制剂纳武利尤单抗不能诱导PD-1的超聚集,而纳武利尤单抗的低亲和力突变体则可以诱导PD-1的超聚集。
不过,我们都知道,PD-1信号通路被激活之后,给T细胞传递的负调节信号,会抑制T细胞的活性[7]。俞晓杰博士的实验结果也证实了之前的发现,低亲和力的纳武利尤单抗突变体会抑制T细胞的活性。也就是说,低亲和力的PD-1抑制剂可能不仅不能治疗癌症,反而会有利于癌症的进展。
总的来说,俞晓杰博士的这一研究表明,抗体的最佳亲和力取决于抗体的应用场景。如果是阻断型抗体,高亲和力最有效;如果是激动型抗体,那亲和力处于中间水平更好。
值得注意的是,到目前为止,针对TNFR家族的激动型抗体治疗癌症的临床表现令人失望。虽然失败的原因有很多,但是英国布里斯托大学的Christoph Wülfing等发现,很多激动型抗体是高亲和力抗体[8]。
或许俞晓杰博士的这项研究成果会重构激动型抗体的设计思路,让激动型免疫调节抗体成为免疫治疗的另一支重要力量。
参考文献:
[1].Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature. 1975;256(5517):495-497. doi:10.1038/256495a0
[2].https://www.southampton.ac.uk/youreit/news/2023/02/01/boosting-anti-cancer-antibodies-by-reducing-their-grip/
[3].Yu X, Orr CM, Chan HTC, et al. Reducing affinity as a strategy to boost immunomodulatory antibody agonism. Nature. 2023. doi:10.1038/s41586-022-05673-2
[4].Viant C, Weymar GHJ, Escolano A, et al. Antibody Affinity Shapes the Choice between Memory and Germinal Center B Cell Fates. Cell. 2020;183(5):1298-1311.e11. doi:10.1016/j.cell.2020.09.063
[5].Forthal DN. Functions of Antibodies. Microbiol Spectr. 2014;2(4):1-17.
[6].Mayes PA, Hance KW, Hoos A. The promise and challenges of immune agonist antibody development in cancer. Nat Rev Drug Discov. 2018;17(7):509-527. doi:10.1038/nrd.2018.75
[7].Curnock AP, Bossi G, Kumaran J, et al. Cell-targeted PD-1 agonists that mimic PD-L1 are potent T cell inhibitors. JCI Insight. 2021;6(20):e152468. doi:10.1172/jci.insight.152468
[8].Wülfing C, Dovedi SJ. For optimal antibody effectiveness, sometimes less is more. Nature. 2023;614(7948):416-418. doi:10.1038/d41586-023-00244-5
文章来源:奇点网