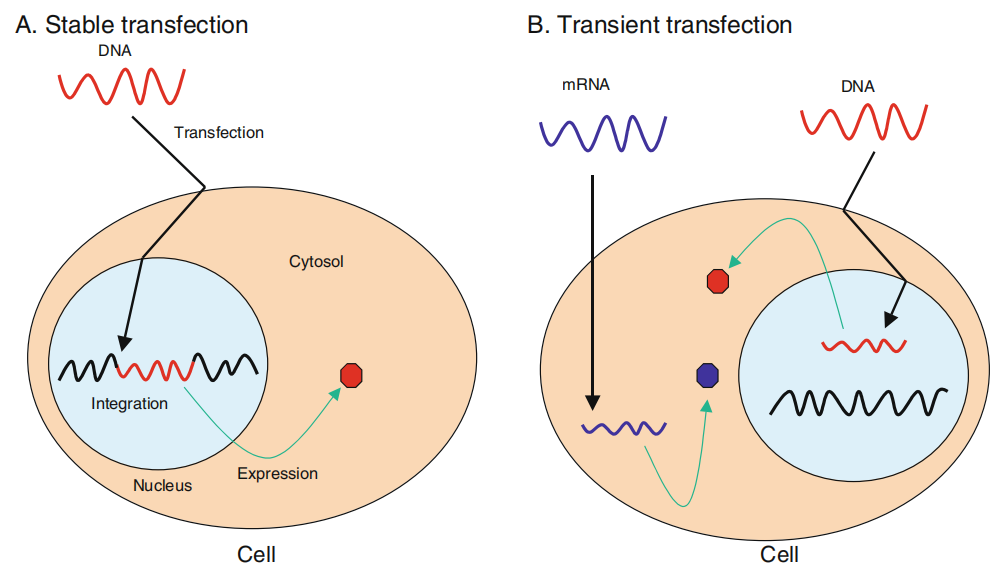
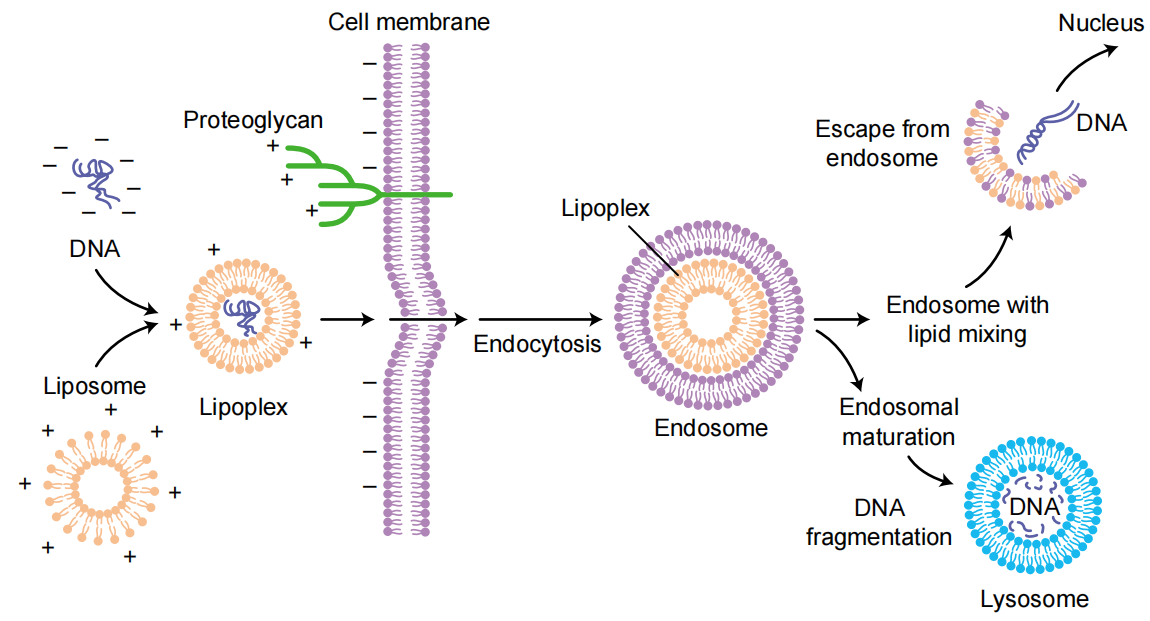
图2 两种转染类型示意图。A.稳定转染B.瞬时转染(Kim T K, Eberwine J H., 2010)
1.瞬时转染
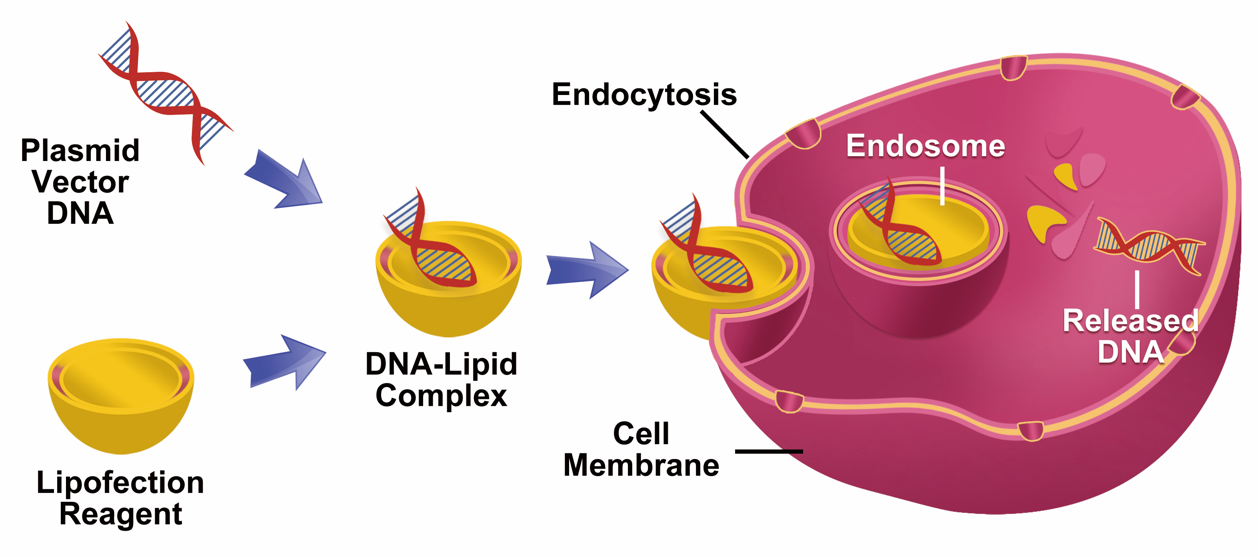
瞬时转染是指外源核酸进入受体细胞后,存在于游离的载体上,不整合到细胞的基因组中,这样外源基因可以在短时间内表达获得目的产物,但随着细胞的分裂增殖外源基因不会进入子代细胞,最终逐渐丢失。瞬时转染基因表达维持的时间较短,所以通常在24~96h内收获细胞,然而,导入的遗传物质的高拷贝数导致其在细胞内的蛋白质表达水平较高,因此,瞬时转染一般用于研究基因或基因产物的短期表达,基因敲除或RNA介导的基因沉默,以及进行蛋白质小规模合成。
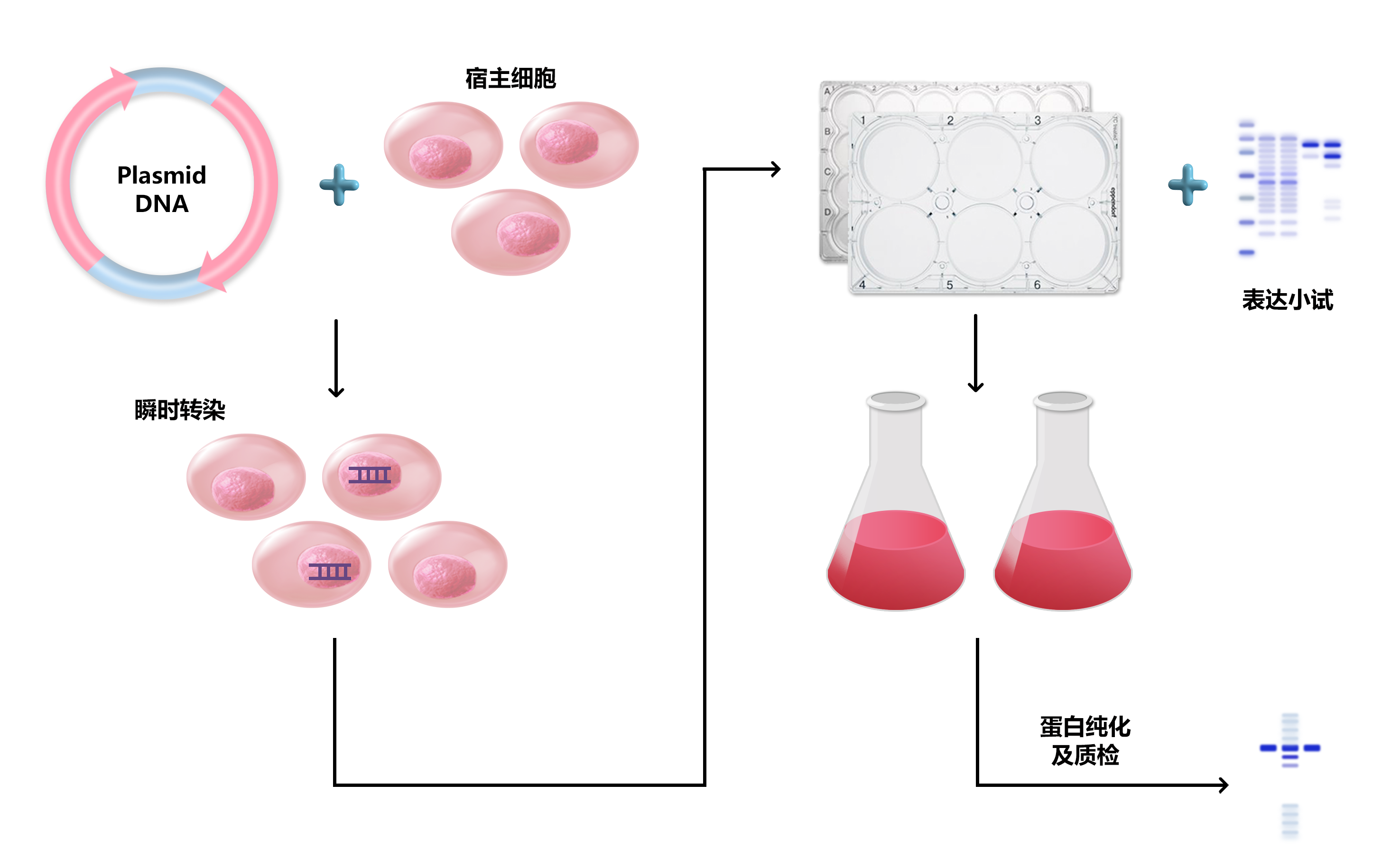
图3 瞬时转染操作步骤。
2.稳定转染
稳定转染是指外源DNA整合到细胞基因组中或作为附加体质粒保留在细胞中,成为细胞基因组的一部分从而得以复制,使宿主细胞可长期表达目的基因,这就是稳定转染细胞的标志。稳定转染细胞的子代细胞也同样表达外源基因,由此形成稳定转染的细胞系。然而,通常是将单拷贝或几个拷贝的外源DNA整合到稳定转染的细胞的基因组中,因此,其表达水平一般低于瞬时转染的表达水平。另外,相对于瞬时转染,稳定转染适用于长期的药理学研究、基因治疗研究、遗传调控机制的研究及大规模的蛋白质合成,周期长,因此成本投入高也更费时费力。
图4 稳定转染操作步骤。
3.瞬转和稳转的区别
稳定转染可以在瞬时转染的基础上建立,只不过需要一个重要的偶发过程:在少数转染细胞中,外源基因能够整合到细胞的基因组中。在建立稳转细胞系时,将外源基因与抗生素抗性基因共转染或依据不同质粒载体含有的抗性标志选用相应的抗生素对细胞进行筛选,就可以筛选出外源基因成功整合到基因组上的细胞,同时剔除瞬时转染的细胞。因为只有稳定转染的细胞才会获得对抗生素的抗性,在长期培养中存活下来,由此,就可以实现对目标细胞的筛选和扩增。常用的抗生素有嘌呤霉素(Puromycin)、G418(Geneticin)等。
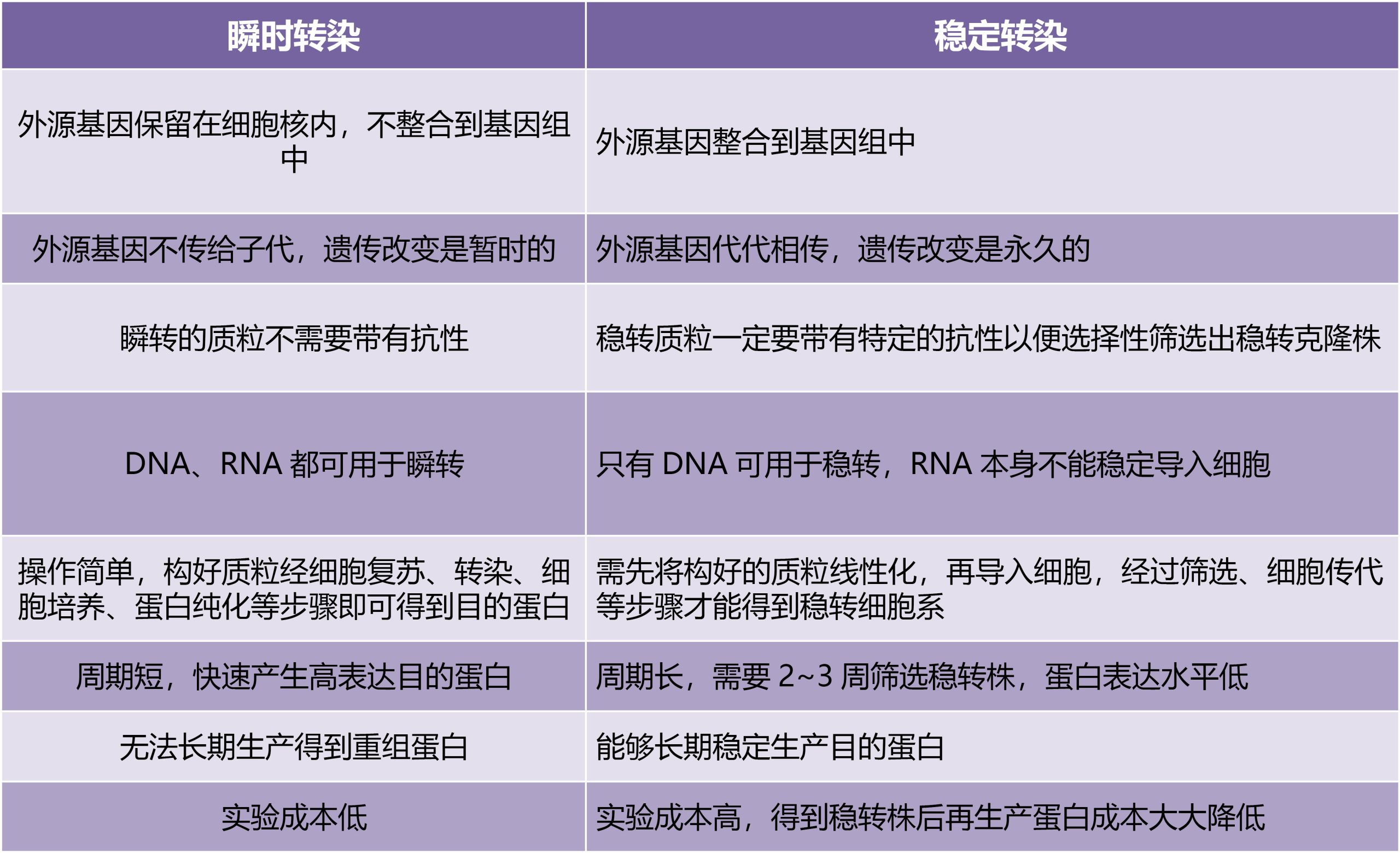
表1 瞬转和稳转的区别
表2 常用转染方法的比较
1.细胞状态
细胞状态不好,会导致转染效率低下,因此,转染前要求良好的细胞状态和细胞活性。转染时细胞密度以70~90%(贴壁细胞)或2×106~4×106细胞/mL(悬浮细胞)为宜,一般不建议用生长几天或传代次数少的细胞做转染,细胞密度过高会严重影响细胞状态(周期进程阻滞,凋亡增加等),细胞密度过低可能会导致生长异常或者由于转染试剂对细胞的毒性导致细胞死亡。
2.质粒
为实现高效率、低毒性的转染,应使用高质量的质粒,结构完整,纯度高,无污染,无菌,无内毒素。如果质粒不纯,带少量盐离子,蛋白、代谢物污染等都会显著影响转染复合物的有效形成;而含有内毒素的质粒对细胞存在很大的毒性作用。另外抗生素一般对真核细胞无毒,但转染过程中细胞通透性增加,使抗生素进入细胞,从而降低细胞活性,导致转染效率低下。
3.载体构建
若质粒基因产物对细胞有毒害作用,则转染难以成功。转染载体的构建选择可调控,强度适合的启动子很重要,可以用空载体或相同载体的其他基因作为对照排除毒性对细胞的影响。
4.转染试剂和DNA的比例
许多转染方法都需要优化转染试剂和DNA的比例。不同细胞系转染效率通常不同,细胞系的选择通常根据实验需要确定,转染试剂也应根据实验要求和细胞特性选择合适的,然后进行预实验,选择合适浓度的DNA,调整DNA与转染试剂的比例,以获得较高的转染效率。
5.转染后筛选时间
转染后筛选不能太早或太晚,因为转染了外源基因的细胞代谢负荷大,增殖较慢,太晚可能会被没有外源基因转入的细胞淹没,导致筛选不出阳性克隆。因此一般是在转染48h之后开始加抗生素筛选。
6.污染
细胞污染会造成转染效率低下,为防止细胞污染应注意避免培养物被细菌、真菌、病毒、支原体或其他细胞种类等污染;避免培养的细胞被支原体污染,必要时进行支原体污染的常规筛查;避免与实验室同时培养的其他种类细胞发生交叉污染。
五、转染效率的验证
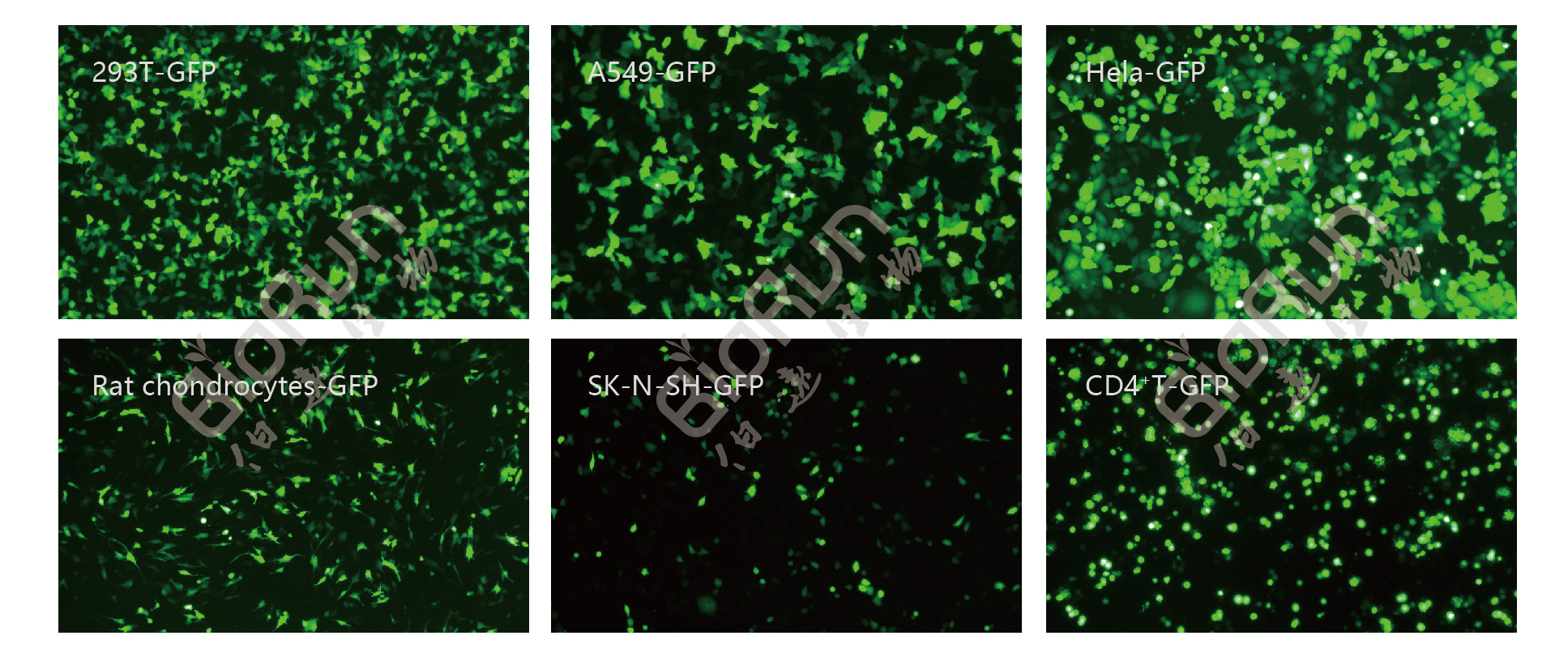
转染完成后需要对转染效率进行验证,1.利用含GFP或RFP之类报告基因的质粒作为阳性对照,使用荧光显微镜或流式细胞仪测定转染细胞和GFP蛋白表达细胞的百分比,评估转染效率;2.利用qPCR法精确定量目的基因。
Kim T K, Eberwine J H. Mammalian cell transfection: the present and the future[J]. Analytical & Bioanalytical Chemistry, 2010, 397(8):3173-3178.