从古代帝王寻求灵丹妙药到现代医学提出各种抗老学说,人类对于长生不老的追求从未停止。那么,你是否曾思考过“延年益寿”与“永葆青春”是一回事吗?
目前关于衰老生物学的研究主要基于寿命的增减,许多干预以延长寿命为主要依据被判定具有“抗衰老”的效果。然而,对于很多物种来说,导致其死亡的主要原因是某些特定的病理变化(比如肿瘤),而并不是机体老化。那么,这些干预措施带来的延年益寿效果是通过抗老化来实现,还是通过靶向与年龄无关的病理机制来实现呢?在此前的研究中,鲜有数据能解答这一疑问。
近日,由德国波恩神经退行性疾病中心Dan Ehninger领衔的研究团队,在《自然·通讯》发表的最新研究成果为以上问题提供了答案[1]。他们利用深度表型分析、分子标记物和转录组数据建立了C57BL/6雄性小鼠年龄敏感性表型(ASPs)的年龄依赖轨迹,这为后续观察假定抗衰老干预(PAAI)的抗衰老效果提供依据。
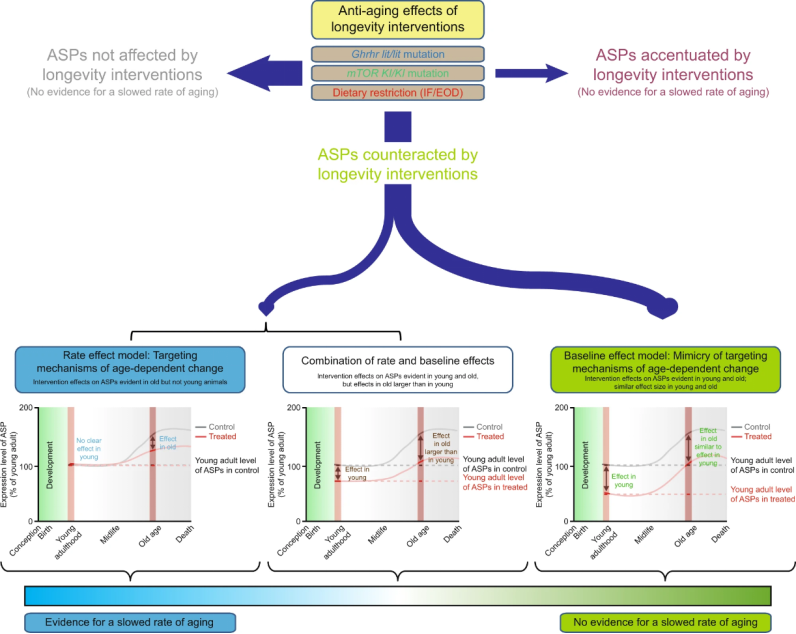
他们通过在小鼠模型上实施不同PAAI措施发现,这些PAAI在ASPs随着年龄增长发生变化之前就开始影响表型。更重要的是,PAAIs措施并不影响ASPs随年龄增长变化的速率。因此,Dan Ehninger团队认为这些能够延长寿命的干预措施实际上能够发挥的抗衰老效果十分有限[2]。
以往大多数关于衰老的研究是以寿命为主要观测指标对抗衰老效果进行评估。然而,对不同小鼠品系的研究发现,小鼠的主要死亡原因是肿瘤(70%-90%),并不是机体老化导致死亡。以寿命为主要观察指标进行分析,可能更多探究的是PAAIs与肿瘤发生之间的关系。也就是说,以寿命为评定抗衰老的唯一指标可能并不能真实反应干预措施的抗衰老效果。
衰老是一个由年轻成年个体转变为疾病风险和死亡风险增加的老年个体的过程,其中包含了多种生理系统变化。这种变化涉及多种层次,包括分子、细胞、组织和有机体等,几乎影响所有组织和器官系统。在整个衰老过程,大量年龄敏感性特征会随着年龄的增长而发生变化。因此,Dan Ehninger团队考虑衰老可以通过评估年龄依赖的表型变化来分析。
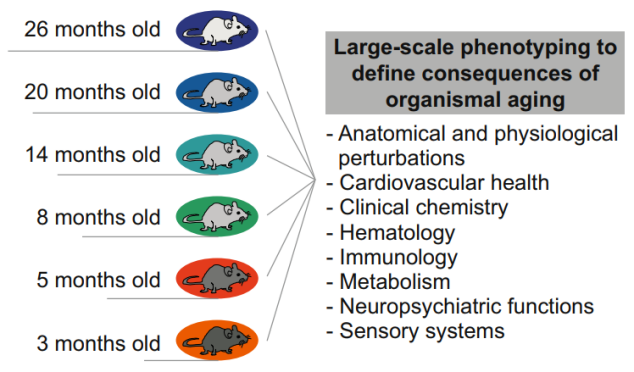
为了绘制小鼠衰老过程中表型的年龄依赖性轨迹,研究者对3、5、8、14、20和26月龄的雄性C57BL/6J小鼠进行了深度表型分析,涉及心血管健康、神经精神功能、感觉系统、临床化学、血液学、免疫学、代谢以及解剖学和生理学等领域,共222种表型。分析结果表明,ASPs的占比为~59%,其中大多数可检测到的变化始于14~20月龄。在3~5月龄时,ASPs变化十分有限。这也就是说,大多数ASPs在青年期(3~5月龄)具有一段相对稳定的时期。
本研究所选择的青年组小鼠在分析开始时为3月龄,在分析完成时5月龄。前文已经提到,ASPs在3~5月龄时为表型稳定期,那么在青年组中ASPs的改变被认为是与年龄无关的效应。通过青年组和老年组的对比,来区分PAAI对ASPs的改变是否与年龄相关。如果与年龄相关,那么PAAI措施可能具备抗衰老的效果。
本研究所选择的老年组小鼠在开始分析时约20月龄,在分析完成时约22月龄。在此月龄区间的小鼠一方面其ASPs已经积累了明显的变化,另一方面此时小鼠的生存率还没有发生明显的变化,可减少生存率差异带来的干扰。
除了遗传因素外,研究者还应用深度表型策略来评估环境因素对于衰老的影响。目前研究最多的环境因素是饮食限制。在前期的研究中,他们也发现间歇性禁食能够延长寿命。因此,研究者利用饮食限制(每隔一天喂食)小鼠模型来观察间歇性禁食能否改善ASPs。
分析结果表明,共有45种ASPs被鉴定为间歇性禁食敏感表型。其中有42种ASPs改变的主要效应因素为饮食,而年龄和饮食之间没有显著的相互作用。青年组小鼠和老年组小鼠的间歇性禁食效应相关分析显示,两组中被饮食干预抑制的ASPs显著正相关(R = 0.60)。这说明,间歇性禁食对于青年组和老年组的ASPs有相似的效应。也就是说,间歇性禁食对ASPs的影响与年龄无关。
参考文献:
[1] Xie K, Fuchs H, Scifo E, et al. Deep phenotyping and lifetime trajectories reveal limited effects of longevity regulators on the aging process in C57BL/6J mice. Nat Commun. 2022;13(1):6830. Published 2022 Nov 11. doi:10.1038/s41467-022-34515-y
[2] DZNE – German Center for Neurodegenerative Diseases. (2022, December 14). Longevity treatments do not slow aging. ScienceDaily. Retrieved December 22, 2022 from www.sciencedaily.com/releases/2022/12/221214092438.htm
[3] Flurkey K, Papaconstantinou J, Miller RA, Harrison DE. Lifespan extension and delayed immune and collagen aging in mutant mice with defects in growth hormone production. Proc Natl Acad Sci U S A. 2001;98(12):6736-6741. doi:10.1073/pnas.111158898
[4] Goodrick CL, Ingram DK, Reynolds MA, Freeman JR, Cider N. Effects of intermittent feeding upon body weight and lifespan in inbred mice: interaction of genotype and age. Mech Ageing Dev. 1990;55(1):69-87. doi:10.1016/0047-6374(90)90107-q
[5] Zhang S, Readinger JA, DuBois W, et al. Constitutive reductions in mTOR alter cell size, immune cell development, and antibody production. Blood. 2011;117(4):1228-1238. doi:10.1182/blood-2010-05-287821
文章来源:奇点网