最近一段时间,新冠对心脏和神经系统的影响,受到了广泛的关注。
前不久,我们介绍了美国国立卫生研究院(NIH)Daniel S. Chertow团队在《自然》上发表的一项尸检研究成果:新冠病毒可在大脑等人体组织中持续存在长达7个月之久[1]。不过这个研究没有研究感染新冠后大脑的组织病理学变化。
近日,由中国科学技术大学附属第一医院/陆军军医大学西南医院卞修武,北京协和医院冷泠,以及陆军军医大学西南医院平轶芳和姚晓红领衔的研究团队,在著名期刊Signal Transduction and Targeted Therapy上发表重要研究成果[2]。
他们对比了9名重症新冠感染者(2020年死亡)和9名年龄相匹配健康人的大脑尸检结果,发现新冠感染者的大脑中小胶质细胞和星形胶质细胞广泛激活,血脑屏障(BBB)被严重破坏,还存在多种单核细胞和T淋巴细胞浸润。
这个研究让我们对新冠感染有了更多的了解,也为相关症状的治疗提供了潜在的靶点。据了解,这也是首个将新冠感染者的大脑与年龄匹配的正常大脑进行比较的研究。
▲ 论文首页截图
已经有很多研究表明新冠病毒可以感染大脑[1],甚至有研究发现感染者大脑中存在脑炎和/或脑膜脑炎[3]。然而,目前还没有研究对新冠感染相关的脑部炎症与浸润性免疫细胞进行全面分析。
为了更深入地了解新冠病毒感染对大脑的影响,卞修武等对2020年武汉的9名重症新冠感染者的大脑开展了尸检,患者的年龄在57岁-87岁之间,中位年龄是77岁。作为对照,他们还研究了9名年龄在50-70岁之间的正常捐献者的大脑。
与Chertow团队不同的是,卞修武团队在所有脑组织样本的神经元和胶质细胞中均未发现新冠病毒的mRNA和病毒蛋白。不过,在新冠感染者的大脑内,他们发现了嗜神经现象(神经细胞被胶质细胞吞噬)和小胶质细胞结节;在正常捐献者大脑内没有发现这两个现象。
▲ 嗜神经现象(上图左)和小胶质细胞结节(下图左)
此外,与正常对照组相比,新冠感染者大脑中胞体增大的处于激活状态的小胶质细胞显著增多;而且表达胶质纤维酸性蛋白GFAP的星形胶质细胞增多,这也意味着星形胶质细胞广泛激活。
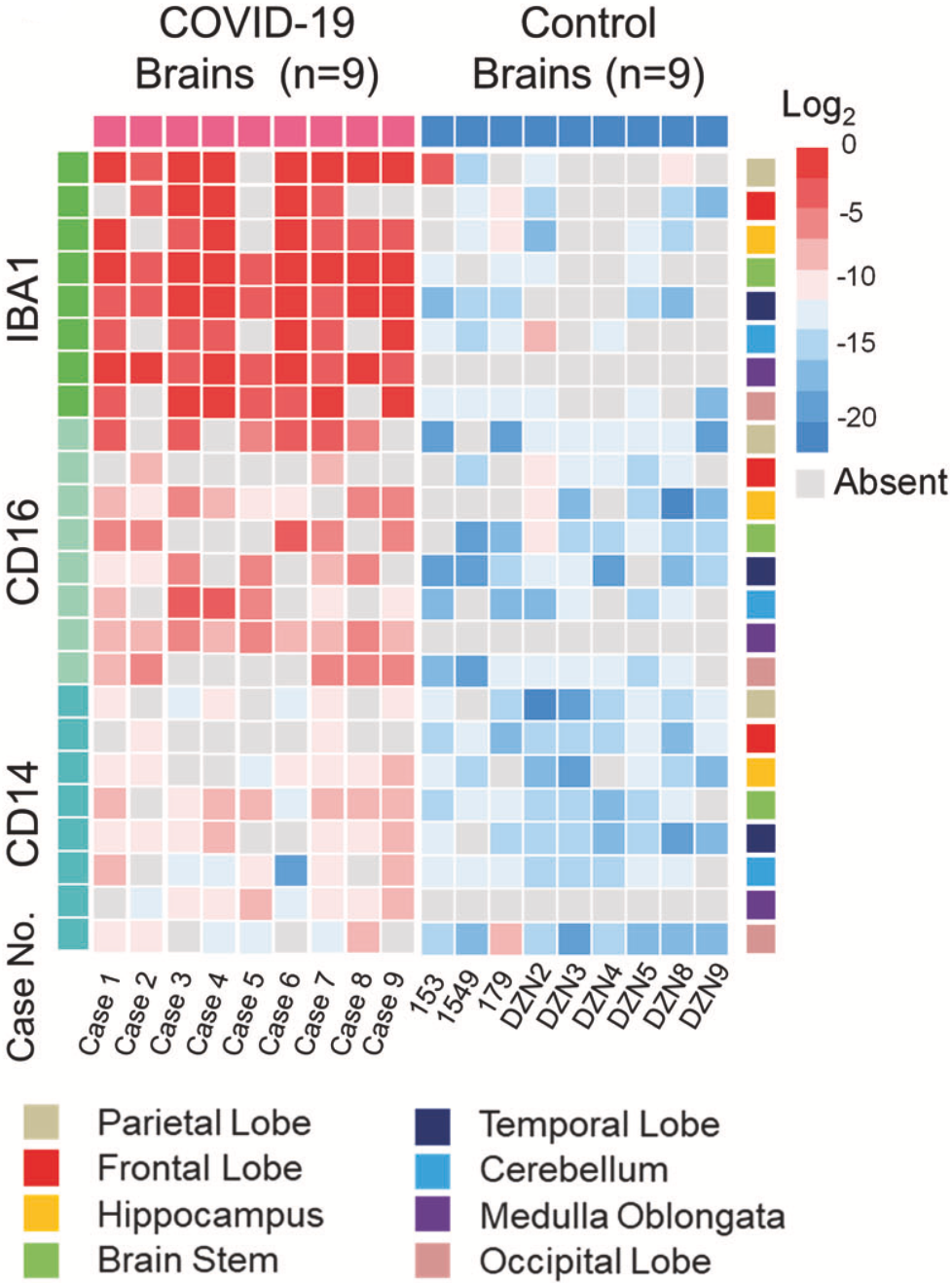
免疫细胞定量分析发现,与对照组相比,新冠感染者大脑中浸润的IBA-1+小胶质细胞、CD16+和CD14+单核细胞明显增加。而且这些炎症细胞主要是在颞叶、额叶、脑干和延髓的血管周围空间和实质(尤其是坏死的神经元周围)增加。
以上结果说明,新冠感染相关的脑部炎症确实存在,而且是以单核细胞为主的脑炎。
▲ 单核细胞的浸润状态
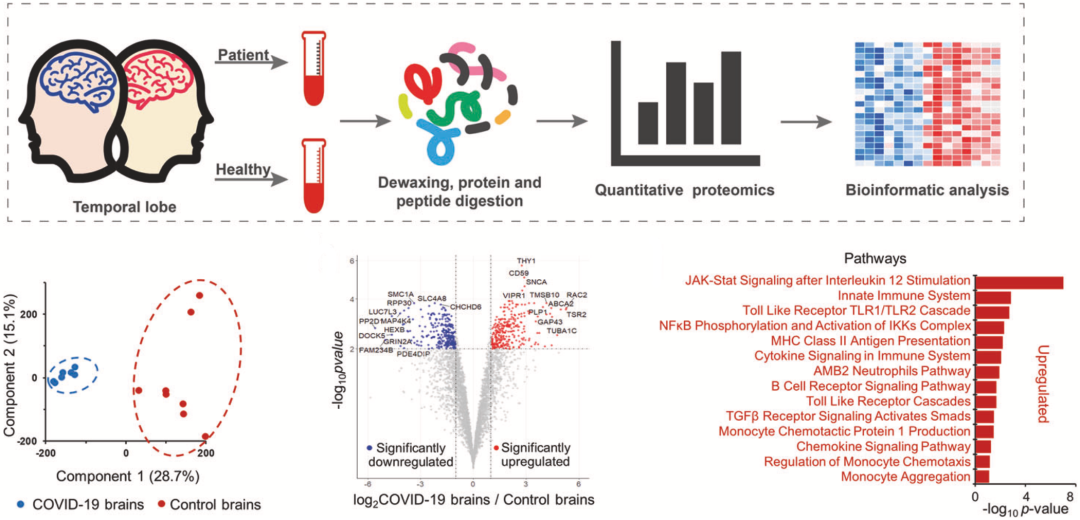
为了搞清楚新冠感染相关的单核细胞脑炎的神经炎症途径,卞修武团队分析了两组大脑的蛋白组数据。
总的来说,对照组大脑与新冠感染者大脑共有572个蛋白存在差异表达。具体来说,驱动炎症因子释放的免疫信号途径相关蛋白,例如IL-12刺激后的JAK-STAT信号通路蛋白和单核细胞趋化蛋白1等,在新冠感染者大脑中上调。
研究团队认为,从蛋白组数据来看,新冠感染者大脑中的小胶质细胞和星形胶质细胞被激活,释放炎症介质(IL-4/6/12等)造成脑损伤。
▲ 蛋白组学研究数据
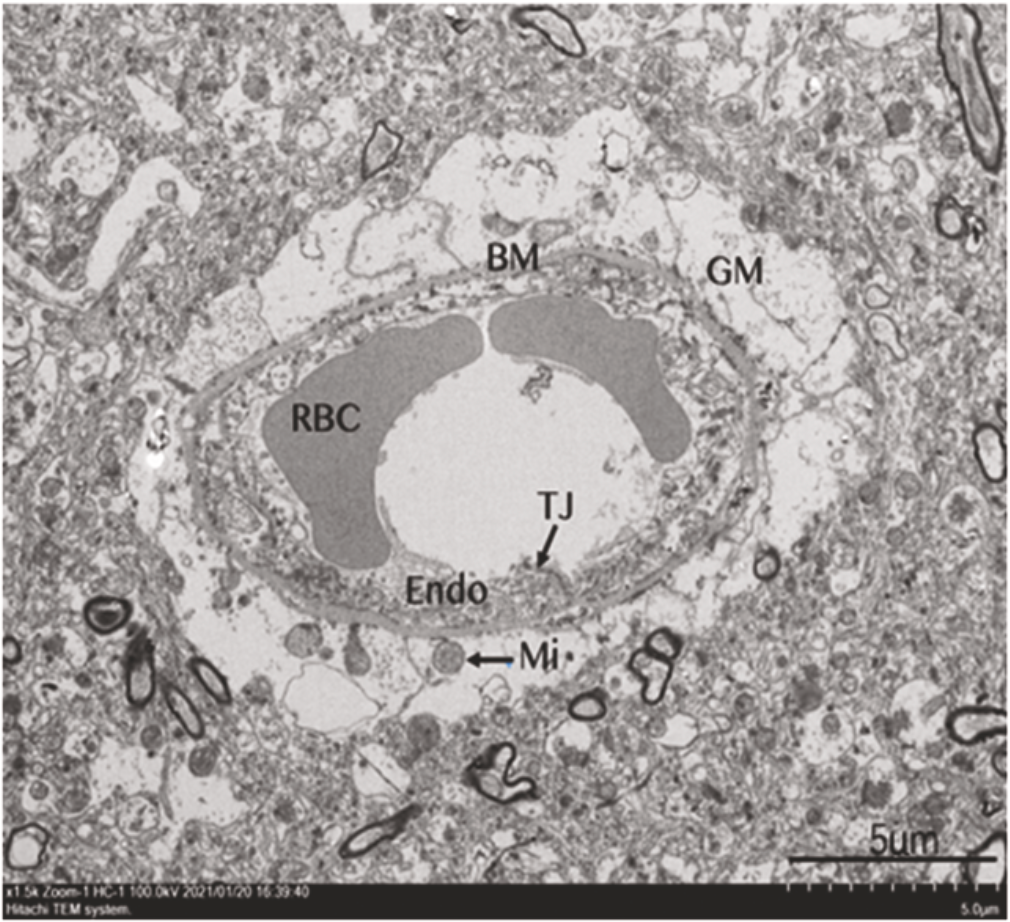
电子显微镜检查结果显示,新冠感染者的血脑屏障受损,表现为毛细血管内皮细胞膨胀,紧密连接异常,基底层破裂,胶质膜膨胀。
此外,新冠感染者的大脑还存在血管源性脑水肿,而且脑水肿的程度与血脑屏障的损伤和星形胶质细胞的激活显著相关。他们还在脑内皮细胞中检测到新冠病毒蛋白。
基于这些研究结果,他们认为新冠感染者的血脑屏障完整性被破坏,而且脑血管中存在病毒感染。
▲ 电镜下受损的血脑屏障
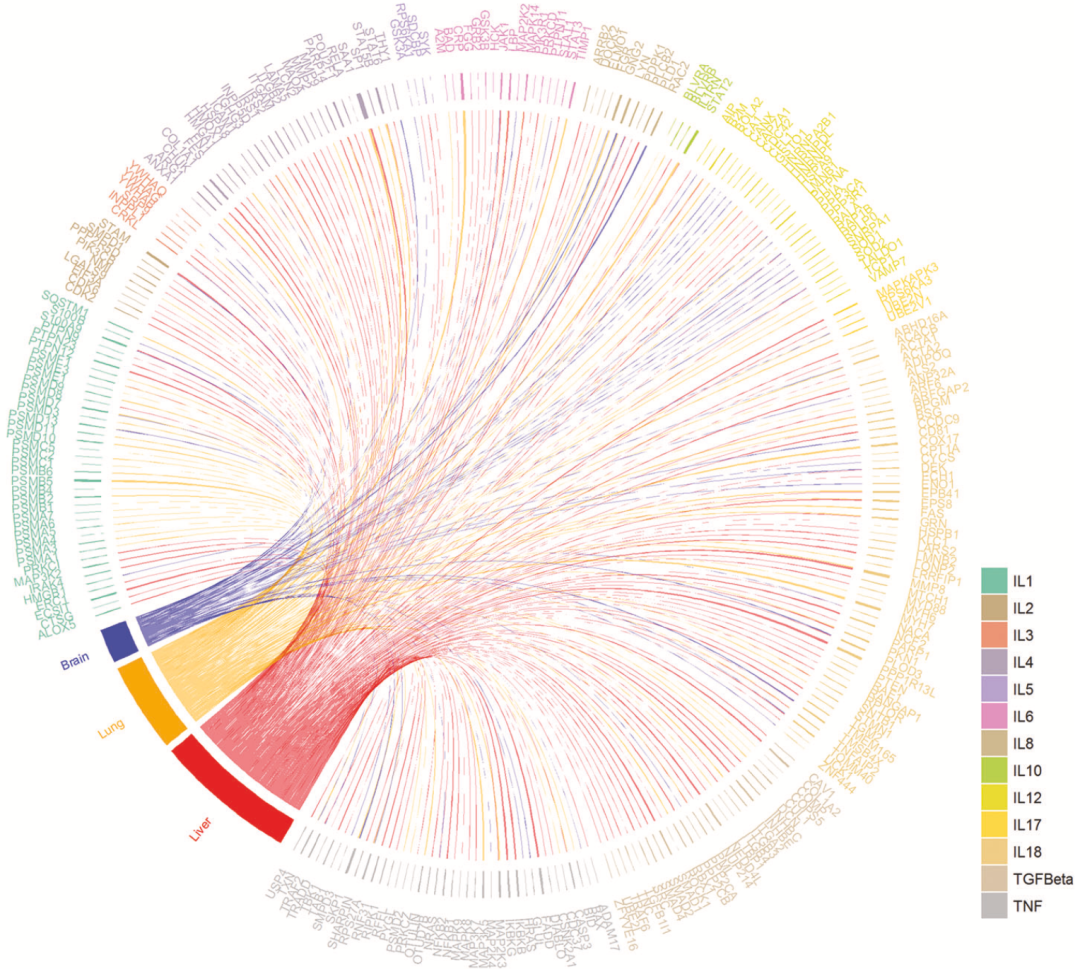
在将导致新冠感染相关脑炎的细胞因子谱与导致肺和肝损伤的做比较之后,卞修武团队发现新冠感染者的脑、肺和肝组织中都含有更多的IL-1、IL-8、IL-12、IL-18和TNF-α,这意味着这些促炎症细胞因子可能促成了全身性炎症风暴的发生。
▲ 新冠感染相关脑炎与肺和肝损伤有相似的炎症因子图谱
在研究的最后,卞修武团队还分析了新冠感染者大脑中的肺炎症性神经病理现象。
在新冠感染者大脑的灰质中发现了神经元坏死、胞质尼氏体(Nissl)溶解/消失,以及巨型神经元的形成;在大脑白质中,他们发现了髓鞘膨胀、破裂或消失。还在5名新冠感染者的大脑内发现了多发囊性软化灶。
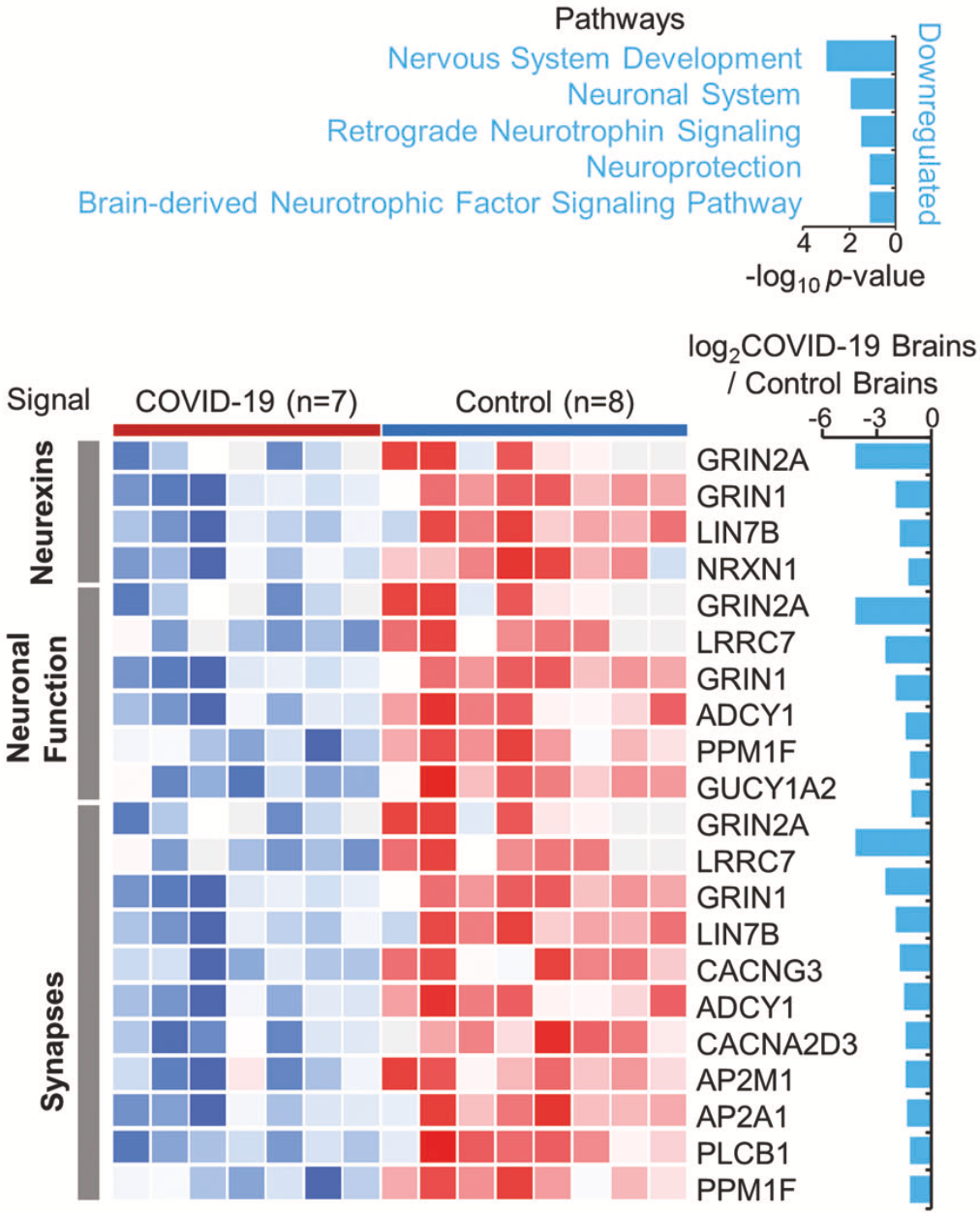
在分析新冠感染者大脑内非炎症信号通路的变化时,发现了神经系统发育、逆行神经营养素信号传导、神经保护和脑源性神经营养因子信号通路的元素被下调。
▲ 大脑内非炎症信号通路的变化情况
总的来说,这个研究告诉我们,新冠感染对大脑的影响是广泛且深入的。此外,这个研究不仅确定了新冠感染相关的单核细胞脑炎的组织病理学和分子特征,还为未来的治疗也提供了潜在的靶点。
需要指出的是,这个研究是在2020年的早期感染者大脑中开展的,目前流行的奥密克戎毒株对大脑病理的影响,还需要进一步研究。
参考文献:
[1].Stein SR, Ramelli SC, Grazioli A, et al. SARS-CoV-2 infection and persistence in the human body and brain at autopsy. Nature. 2022;612(7941):758-763. doi:10.1038/s41586-022-05542-y
[2].Zhang PP, He ZC, Yao XH, et al. COVID-19-associated monocytic encephalitis (CAME): histological and proteomic evidence from autopsy. Signal Transduct Target Ther. 2023;8(1):24. doi:10.1038/s41392-022-01291-6
[3].Pilotto A, Odolini S, Masciocchi S, et al. Steroid-Responsive Encephalitis in Coronavirus Disease 2019. Ann Neurol. 2020;88(2):423-427. doi:10.1002/ana.25783
文章来源:奇点网