MI后的持续过度炎症反应会放大心肌损伤和心脏功能障碍,而具有修复性基因特征的单核-巨噬细胞可调节炎症消退和心脏修复,也就是说,单核-巨噬细胞中修复信号的早期激活对于及时恢复免疫稳态和MI后修复过程的启动至关重要。MI后,大量血单核细胞浸润缺血区和边缘区并分化为巨噬细胞,巨噬细胞是MI后7天内梗死巨噬细胞的主要来源(图1)。
研究证实,巨噬细胞是先天性免疫系统的基本细胞成分,在新生心脏再生过程中可渗透到受损心肌,MI后,循环血单核细胞迅速渗入梗死区并分化为相应的巨噬细胞,巨噬细胞作为调节因子和效应因子,可促进梗死的修复。在MI炎症期,M1巨噬细胞是最初对死亡细胞和细胞外基质(ECM)碎片的清除有反应的主要亚型;在MI增殖期,M2巨噬细胞逐渐占据优势,促进受损心肌组织的修复和再生,并且巨噬细胞极化的转换在转录和翻译水平上受到信号网络的严格调控(图3,4)。虽然巨噬细胞在MI后心脏浸润中已得到充分研究,但单核细胞在进入受伤心脏之前的修复性转录反应却知之甚少。
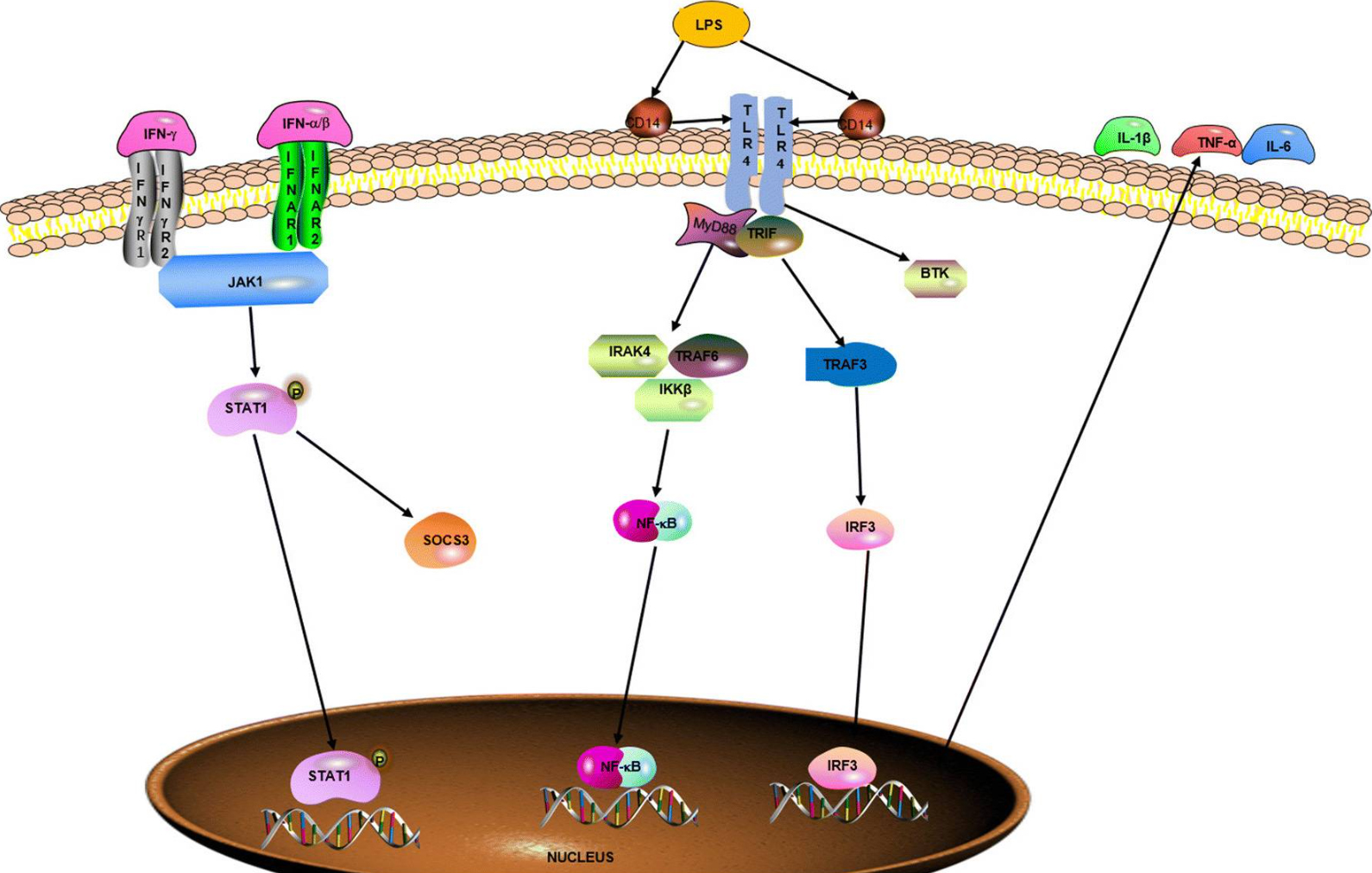
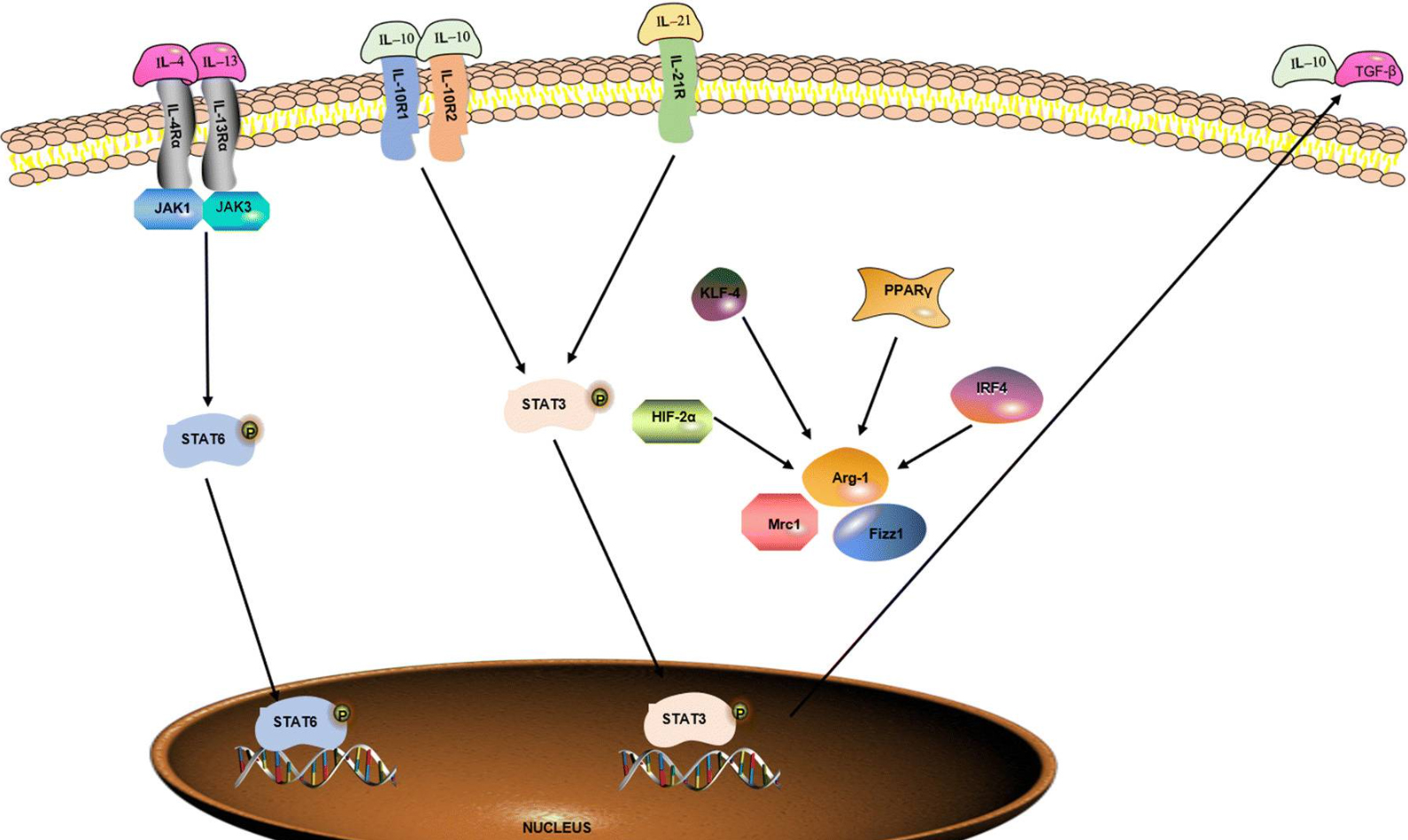
图3 调节M1巨噬细胞极化的信号通路(Zhang et al., 2021)。
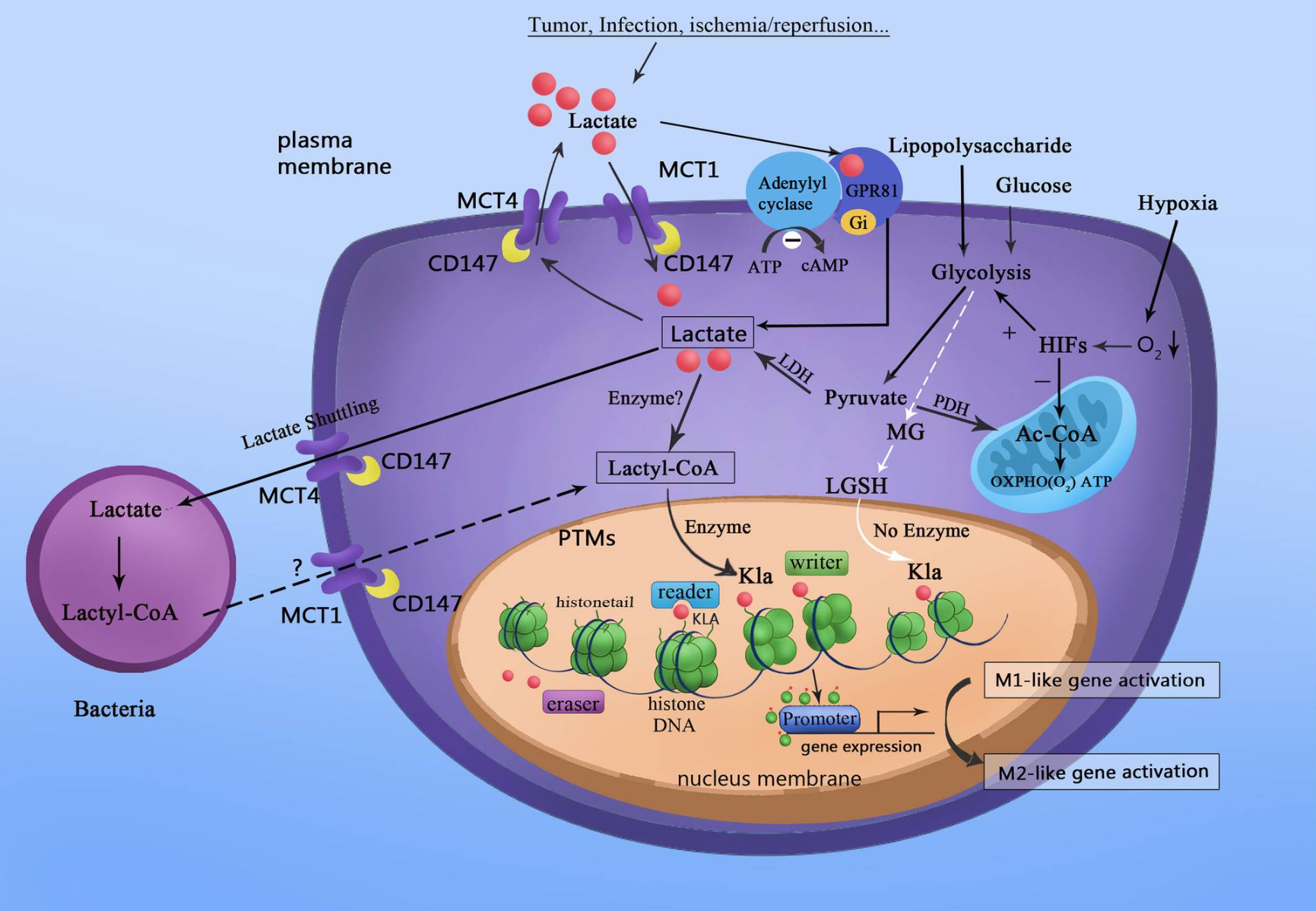
图5 乳酸作为一种信号分子,通过组蛋白赖氨酸乳酸盐在M1巨噬细胞中刺激基因转录(Xin et al., 2022)。
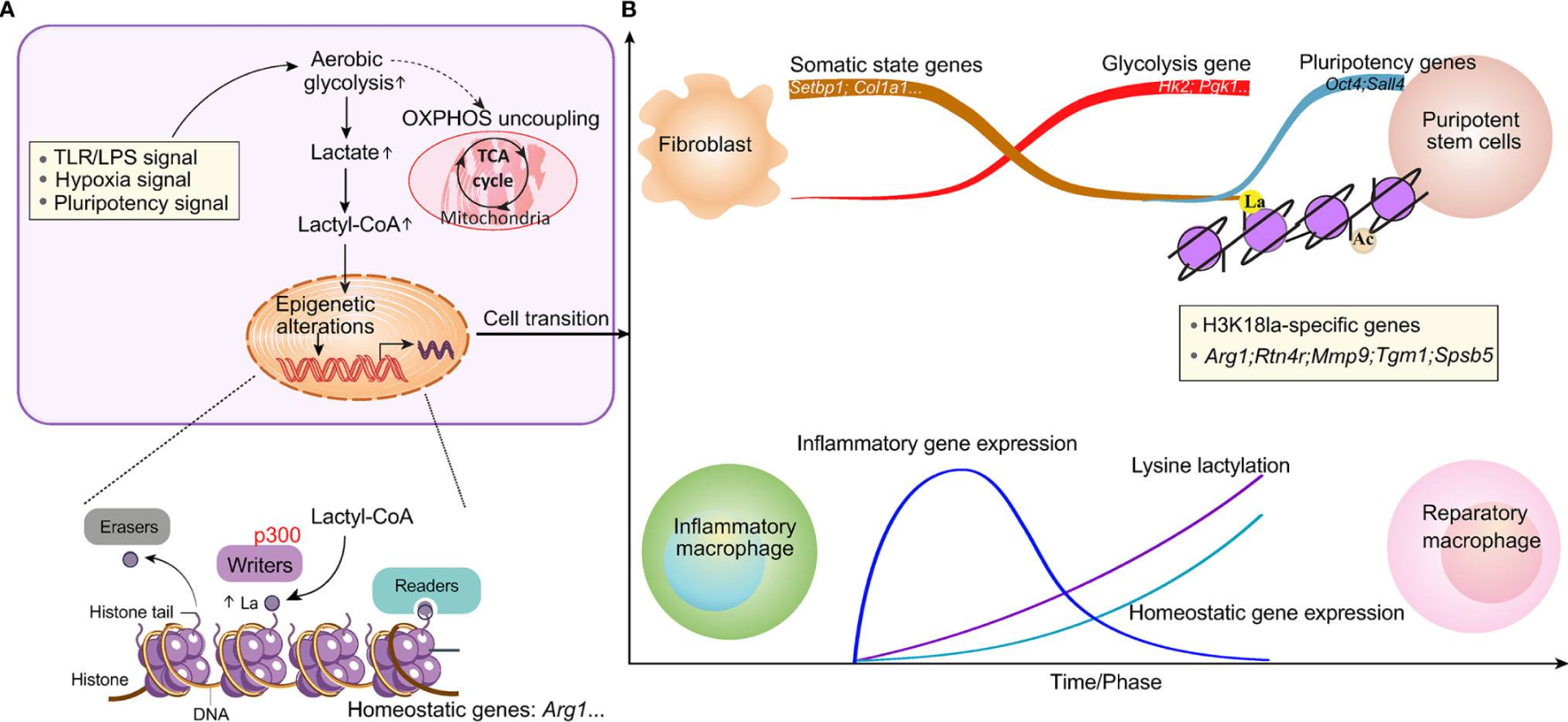
研究显示,在M1巨噬细胞极化过程中,组蛋白乳酸化启动内源性乳酸时钟,诱导修复性基因表达,促进免疫稳态,形成细胞表型的表观遗传改变(图6)。最近的研究证实了组蛋白乳酸化在肠道炎症、败血症、肺纤维化和其他免疫相关病理条件中的调节作用。然而,其在MI后修复性转录早期远程激活中的模式及角色仍不清楚。
图6 乳酸诱导形成细胞表型的表观遗传改变(Chen et al., 2021)。
2022年11月11日,哈尔滨医科大学第二附属医院心内科于波团队在Circulation Research上发表了题为“Histone Lactylation Boosts Reparative Gene Activation Post–Myocardial Infarction”的研究性论文。在本研究中,团队证明组蛋白乳酸化通过促进修复性基因转录以调节单核-巨噬细胞的抗炎和促血管生成双重活性,并证实组蛋白乳酸化有利于修复环境并改善MI后的心脏功能。此外,作者还探讨了单核细胞组蛋白乳酸化在再灌注心肌梗死中的潜在作用,机制上为证实单核细胞在MI早期阶段经历代谢重编程提供新的证据,并证实糖酵解失调及MCT1介导的乳酸转运可促进组蛋白乳酸化。最后,揭示了IL-1β依赖性GCN5可发挥组蛋白H3K18乳酸化的催化作用,阐明了其作为单核细胞组蛋白乳酸化上游调控元件和MI后下游修复基因表达的潜在作用,这对于建立免疫稳态和MI后心脏修复过程的及时激活是必不可少的。
简而言之,本研究确定并验证了MI后心脏复苏前单核细胞修复反应的早期编程模式,并探讨了组蛋白乳酸化在MI中的动态模式,为MI后代谢组-表观基因组-免疫级联反应机制提供了新的视角(图7)。
Kim Y, Nurakhayev S, Nurkesh A, et al. Macrophage Polarization in Cardiac Tissue Repair Following Myocardial Infarction. Int J Mol Sci. 2021;22(5):2715.
Ma Y, Mouton AJ, Lindsey ML. Cardiac macrophage biology in the steady-state heart, the aging heart, and following myocardial infarction. Transl Res. 2018;191:15-28.
Wang N, Wang W, Wang X, et al. Histone Lactylation Boosts Reparative Gene Activation Post-Myocardial Infarction. Circ Res. 2022;131(11):893-908.
Xin Q, Wang H, Li Q, et al. Lactylation: a Passing Fad or the Future of Posttranslational Modification. Inflammation. 2022;45(4):1419-1429.
Zhang Z, Tang J, Cui X, et al. New Insights and Novel Therapeutic Potentials for Macrophages in Myocardial Infarction. Inflammation. 2021;44(5):1696-1712.