以CAR-T疗法为代表的T细胞免疫疗法,已经在一些恶性肿瘤的治疗中展现出令人鼓舞的效果,但目前还难以获得持久的疗效,造成这个现象的原因包括T细胞耗竭、T细胞衰老、免疫抑制的肿瘤微环境等[1,2]。
对CAR-T细胞进行改造,使其克服这些困难,是目前研究的重点,而基因编辑技术为改造T细胞提供了一个绝佳的机会,体外CRISPR基因编辑技术不仅可以用于制造肿瘤特异性T细胞[3],还能够用来筛选调控T细胞功能的关键基因[4,5]。
近期,斯坦福大学医学院Crystal L.Mackall教授领衔的研究团队在顶级学术期刊《科学》上发表研究成果[6],他们通过全基因组CRISPR敲除筛选发现,敲除中介体复合物上的激酶——MED12,能够十分显著地提升T细胞的抗肿瘤活性,并使其维持效应表型。
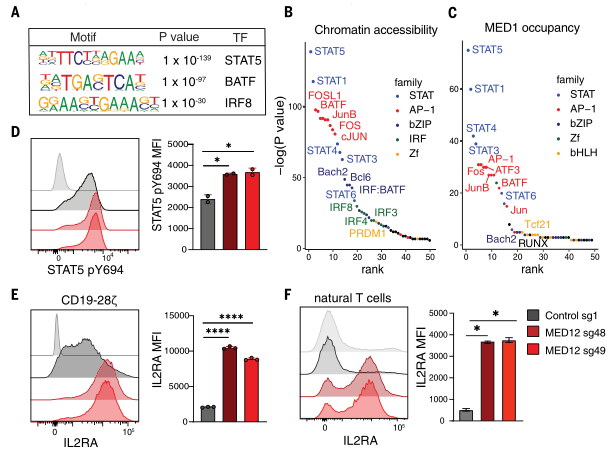
研究显示,敲除MED12后中介体与染色质上增强子区域的结合,尤其是转录因子STAT和AP-1的区域结合增加,从而上调了T细胞上IL2RA的表达,使T细胞对IL-2的响应能力增强,提高了T细胞的抗肿瘤活性。
论文首页截图
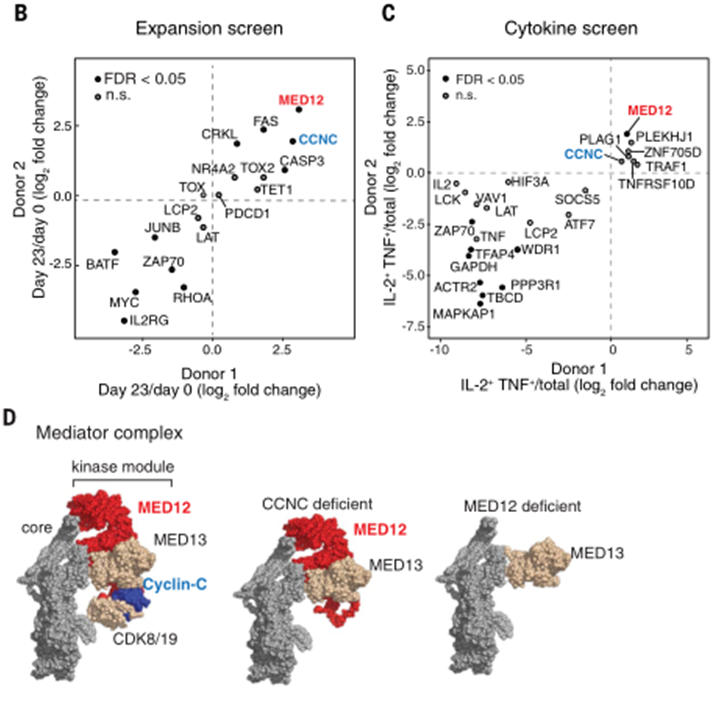
为了筛选出抑制T细胞中增殖以及细胞因子分泌的基因,研究团队在人源CAR-T细胞中进行全基因组CRISPR敲除筛选,分析敲除不同的基因后,T细胞的增殖以及细胞因子分泌能力强弱。在敲除中介体复合物中的激酶MED12以及细胞周期蛋白C(CCNC)后,T细胞的增殖以及细胞因子分泌能力均显著增强。
敲除MED12或CCNC,可增强T细胞的增殖及细胞因子分泌能力
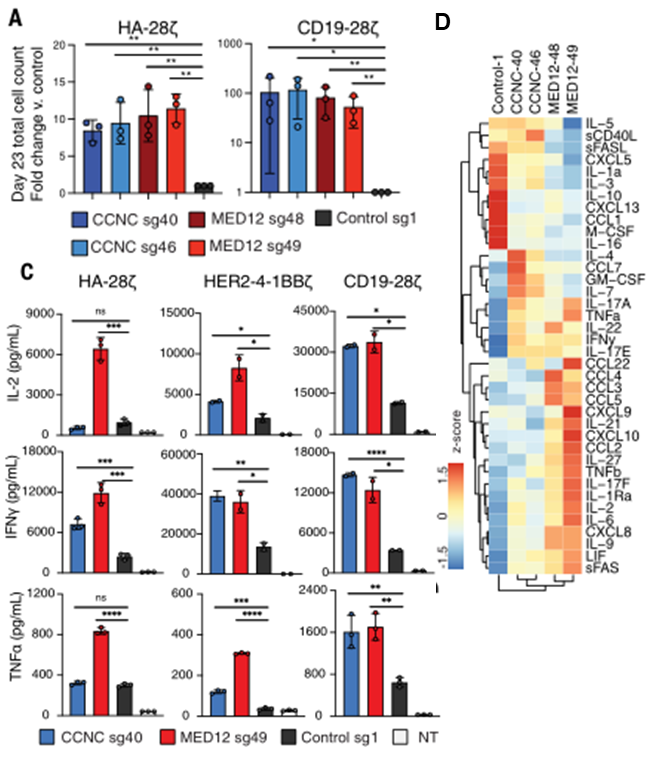
为了验证上述CRISPR筛选的结果,研究团队在CAR-T细胞中敲除了MED12或CCNC,检测其增殖能力以及细胞因子分泌功能。长达23天的体外培养结果显示,敲除了MED12或CCNC后,CAR-T细胞的增殖能力显著增强,并且这种增强与CAR靶向的抗原以及CAR内部的共刺激结构域无关。
流式细胞术以及多重免疫分析结果显示,在与肿瘤细胞共培养、并敲除MED12或CCNC后,CAR-T细胞分泌更高水平的促炎性细胞因子(IFN-γ、TNF-α、IL-6、IL-17)、炎性趋化因子(CXCL10、CCL3)和促进T细胞存活以及分化的共同γ链细胞因子(IL-2、IL-9)。
敲除MED12和CCNC,可增强CAR-T细胞的增殖及细胞因子分泌功能
既然敲除MED12或CCNC后,CAR-T细胞的增殖以及细胞因子分泌能力均得到增强,那么其抗肿瘤能力是否得到了提升呢?
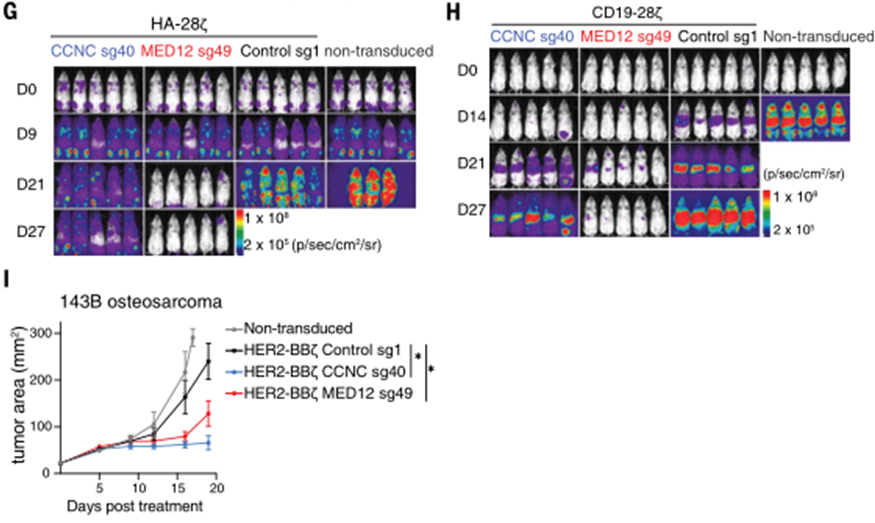
为了探究这个问题,研究团队给予荷瘤小鼠CAR-T细胞治疗,结果显示,敲除MED12或CCNC的CAR-T细胞更加有效地抑制了肿瘤的生长,并显著延长了荷瘤小鼠的生存期。
敲除MED12和CCNC,可增强CAR-T细胞的增殖及细胞因子分泌功能
既然敲除MED12或CCNC后,CAR-T细胞的增殖以及细胞因子分泌能力均得到增强,那么其抗肿瘤能力是否得到了提升呢?
为了探究这个问题,研究团队给予荷瘤小鼠CAR-T细胞治疗,结果显示,敲除MED12或CCNC的CAR-T细胞更加有效地抑制了肿瘤的生长,并显著延长了荷瘤小鼠的生存期。
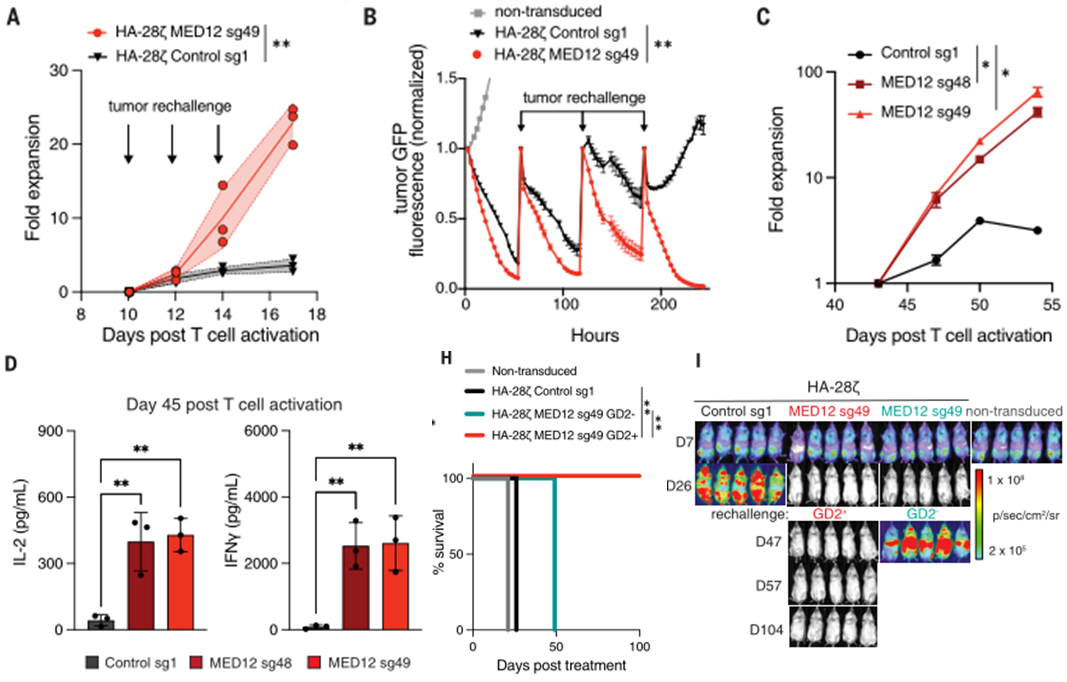
敲除MED12的CAR-T细胞长久作战能力得到显著提升
为了探究敲除MED12增强T细胞抗肿瘤活性的机制,研究团队使用ChIP-seq检测敲除MED12后,CAR-T细胞内的中介体复合物与染色质的结合位点是否发生变化。结果显示,敲除MED12之后,中介体复合物与染色质的结合显著增加,并且结合增加的位点中包含了促进T细胞效应分化与存活的基因(包括TCF7、IFNG、IL2RA等)。
接下来,研究团队结合ATAC-seq以及ChIP-seq等技术,寻找敲除MED12后CAR-T细胞中最关键的转录调控变化。结果显示,敲除MED12后CAR-T细胞中STAT5的磷酸化水平显著升高并伴随其下游基因IL2RA表达的上调,这显著增加了T细胞对IL-2的敏感度。
深入的分析表明,敲除MED12增加了STAT5结合基序处的染色质开放程度,并且增加了中介体复合物与STAT5的共定位,增加了IL2RA的表达,使T细胞对IL-2更加敏感,从而启动一个前馈反应,增加STAT5的磷酸化水平,进一步维持了IL2RA的高表达与T细胞的抗肿瘤活性。
敲除MED12后,STAT5的磷酸化水平以及IL2RA的表达显著上调
总的来说,这项研究成果表明,敲除中介体复合物中的激酶MED12能够显著增强T细胞的抗肿瘤能力,并揭示其内在机制为启动IL2RA-STAT5-IL2RA正反馈循环,增强T细胞对IL-2的敏感性,维持其长期存活、增殖、细胞因子分泌以及细胞毒功能。
研究概括图
对T细胞进行工程化改造以提高其清除致病细胞的能力是一项革命性的工作,CAR-T细胞已经在肿瘤免疫治疗、抗衰老[7]、抗纤维化[8]等多个领域崭露头角。寻找限制T细胞增殖以及效应功能的因素,进一步对CAR-T细胞进行优化将会为人类的健康前景产生积极的影响。
这项研究成果提示,敲除CAR-T细胞中的MED12有望改善现有的CAR-T细胞治疗效果,为更多患者带来希望。
参考文献:
1. J. A. Fraietta, Determinants of response and resistance to CD19 chimeric antigen receptor (CAR) T cell therapy of chronic lymphocytic leukemia. Nat. Med.24, 563–571 (2018).
2. K. G. Anderson, I. M. Stromnes, P. D. Greenberg, Obstacles posed by the tumor microenvironment to T cell activity: A case for synergistic therapies. Cancer Cell31, 311–325 (2017).
3. E. A. Stadtmauer, CRISPR-engineered T cells in patients with refractory cancer. Science367, eaba7365 (2020).
4. E. Shifrut, J. Carnevale, V. Tobin, T. L. Roth, J. M. Woo, C. T. Bui, P. J. Li, M. E. Diolaiti, A. Ashworth, A. Marson, Genome-wide CRISPR screens in primary human T cells reveal key regulators of immune function. Cell175, 1958–1971.e15 (2018).
5. J. A. Belk, W. Yao, N. Ly, K. A. Freitas, Y.-T. Chen, Q. Shi, A. M. Valencia, E. Shifrut, N. Kale, K. E. Yost, C. V. Duffy, B. Daniel, M. A. Hwee, Z. Miao, A. Ashworth, C. L. Mackall, A. Marson, J. Carnevale, S. A. Vardhana, A. T. Satpathy, Genome-wide CRISPR screens of T cell exhaustion identify chromatin remodeling factors that limit T cell persistence. Cancer Cell40, 768–786.e7 (2022).
6. Freitas KA, Belk JA, Sotillo E, et al. Enhanced T cell effector activity by targeting the Mediator kinase module. Science. 2022;378(6620):eabn5647. doi:10.1126/science.abn5647
7. Amor C, Feucht J, Leibold J, et al. Senolytic CAR T cells reverse senescence-associated pathologies. Nature. 2020;583(7814):127-132. doi:10.1038/s41586-020-2403-9
8. Aghajanian H, Kimura T, Rurik JG, et al. Targeting cardiac fibrosis with engineered T cells [published correction appears in Nature. 2019 Dec;576(7785):E2]. Nature. 2019;573(7774):430-433. doi:10.1038/s41586-019-1546-z
文章来源:奇点网