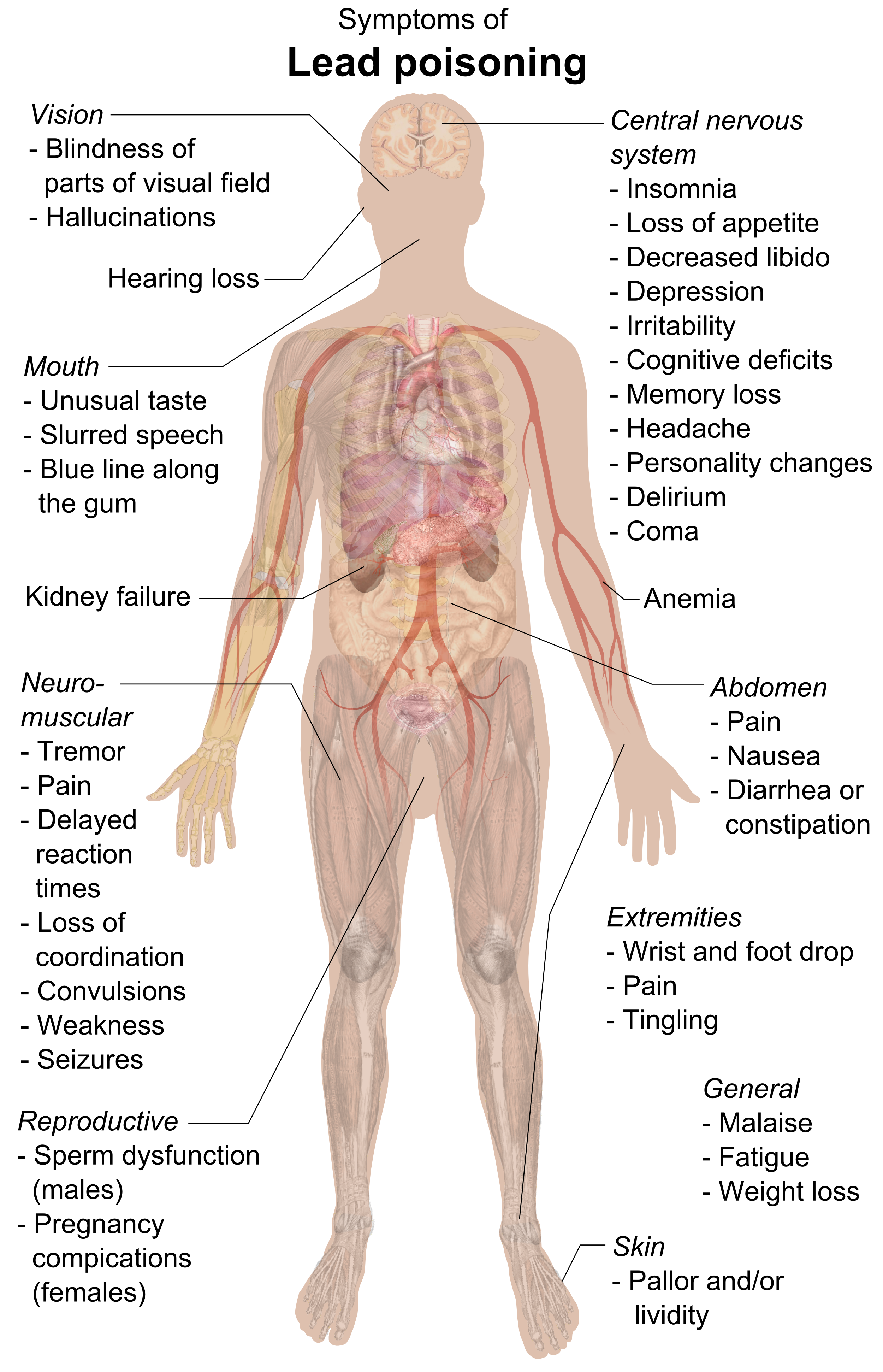
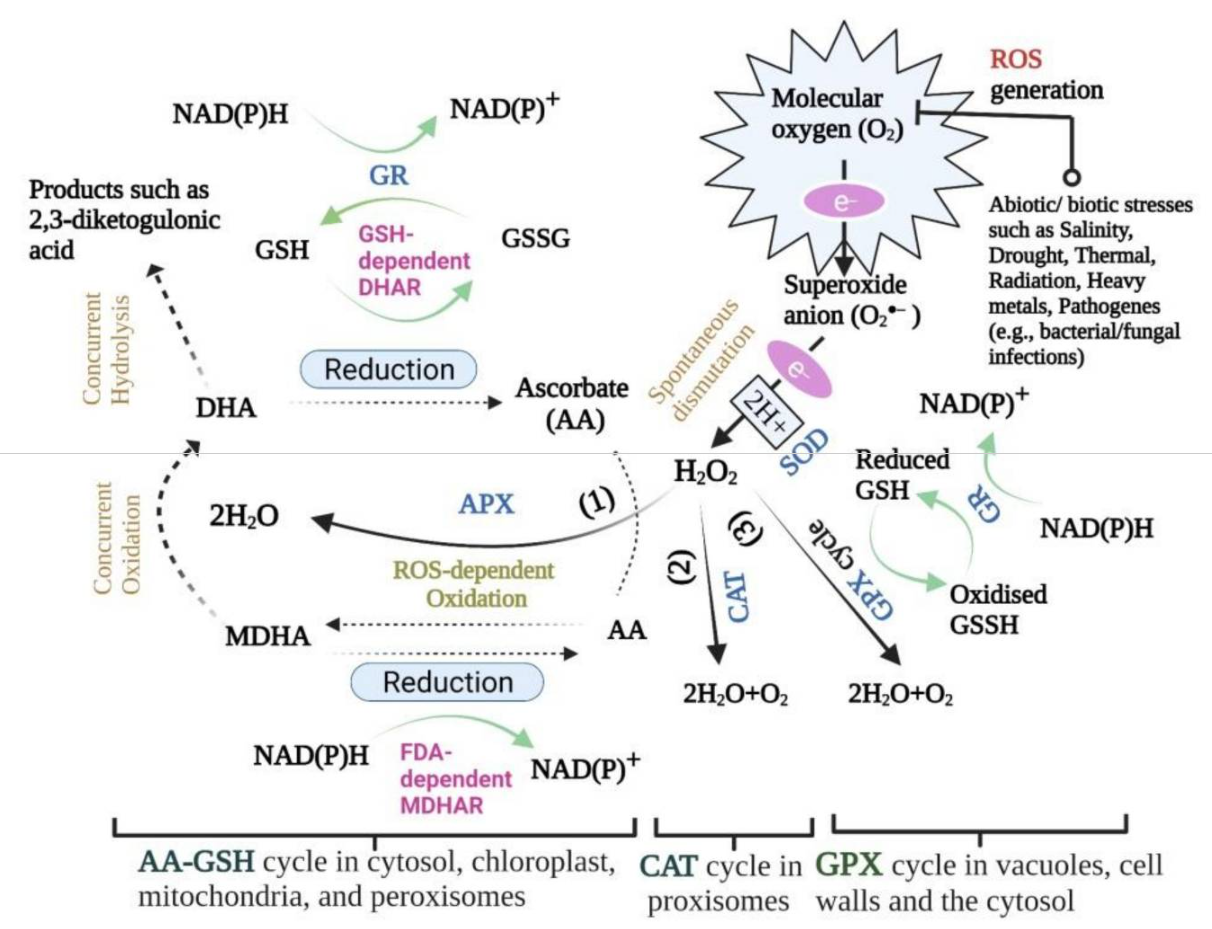
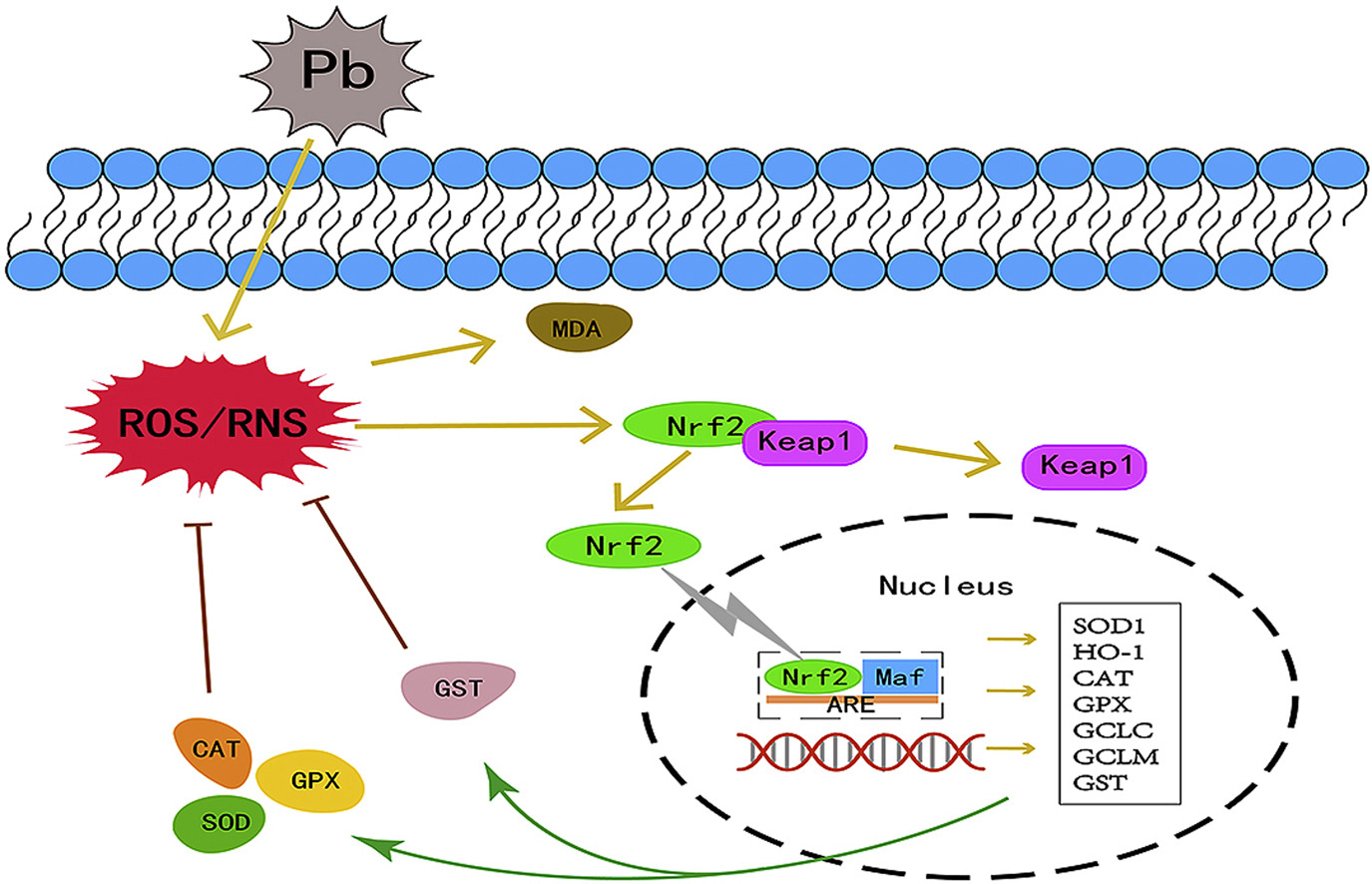
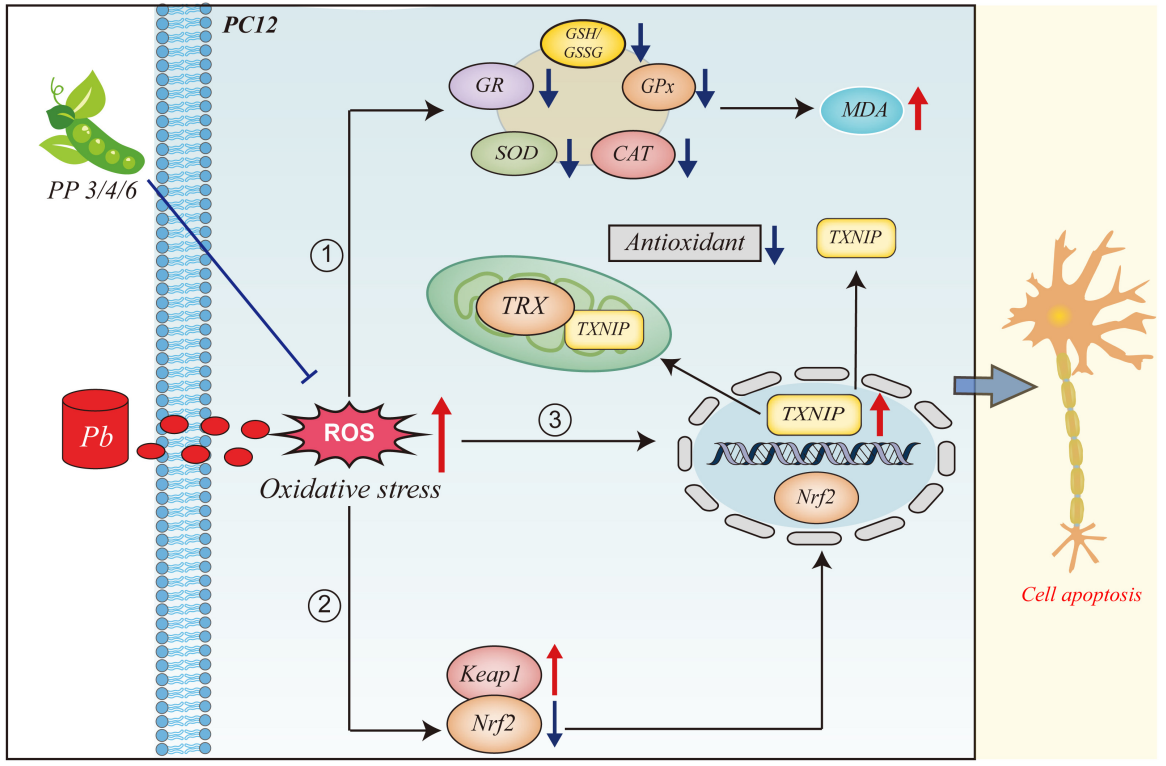
图1 氧化应激示意图(Zandi P, Schnug E., 2022)。
研究显示,NRF2-KEAP1信号通路是抗氧化应激反应的重要调节因子。铅暴露通过激活Nrf2/Keap1途径加剧氧化应激(图2)。进一步地,有研究表明,硫氧还蛋白相互作用蛋白(TXNIP)是体内广泛表达的内源性硫氧还素(TRX)阻遏蛋白,在细胞中,硫氧还蛋白相互作用蛋白是α-阻遏蛋白家族中唯一能与TRX结合的蛋白,其半胱氨酸63位和半胱氨酸247位可与还原的TRX活性位点的疏水基团形成二硫键,从而抑制TRX的抗氧化功能并促进活性氧ROS积累。此外,研究还发现,TXNIP对TRX/ROS的作用被p38 MAPK信号通路抑制剂SB03580阻断,这表明TXNIP参与了p38 MAPK对细胞内ROS的调节(Su et al., 2015)。
从豌豆中提取的蛋白质具有多种生物学功能。例如,豌豆中的粘性可溶性多糖可以提高葡萄糖耐量,降低血脂,并增加回肠胆汁酸的分泌(Sarmadi BH, Ismail A., 2010);豌豆蛋白可有效降低STZ诱导的糖尿病小鼠的血糖(Liu et al., 2021),水解物可降低高血压大鼠的血压(Li et al., 2011)。此外,豌豆籽蛋白在结肠炎小鼠模型中显示出抗炎作用(Utrilla et al., 2015)。
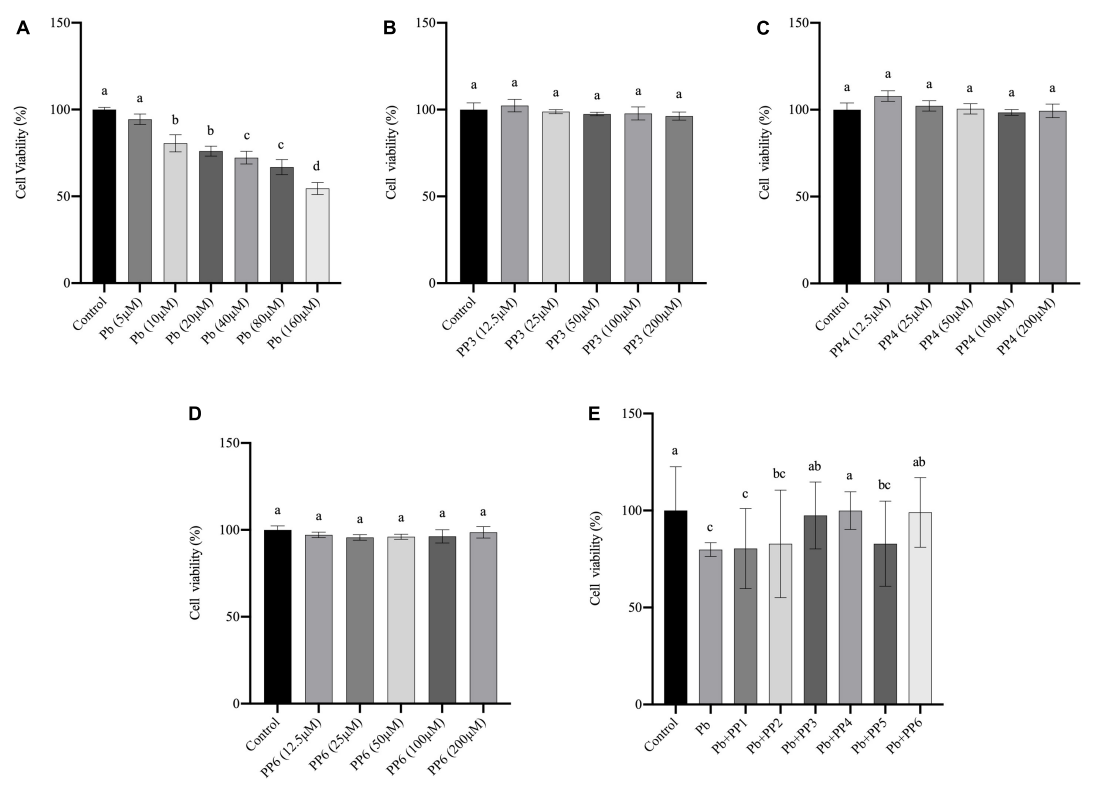
2、CCK检测细胞活力:使用不同浓度的Pb(0~160μM)处理PC12细胞24h,用CCK-8检测细胞活力,结果如图4A所示;使用不同浓度,不同种类的豌豆肽(0~200μM PP3/4/6)处理PC12细胞4h,用CCK-8检测细胞活力,结果如图4B/C/D所示;使用200μM的豌豆肽(PP1~PP6)预处理PC12细胞4h,再用10μM的Pb处理24h,用CCK-8检测细胞活力,结果如图4E所示。
图4 不同处理对PC12细胞活力的影响。(A)Pb对PC12细胞活力的影响;PP3(B)、PP4(C)和PP6(D)对PC12细胞活力的影响;(E)PP1~6对Pb暴露PC12细胞活力的影响。柱状图的值表示平均值±SD(n≥3)。不同上标字母表示差异(P<0.05)。
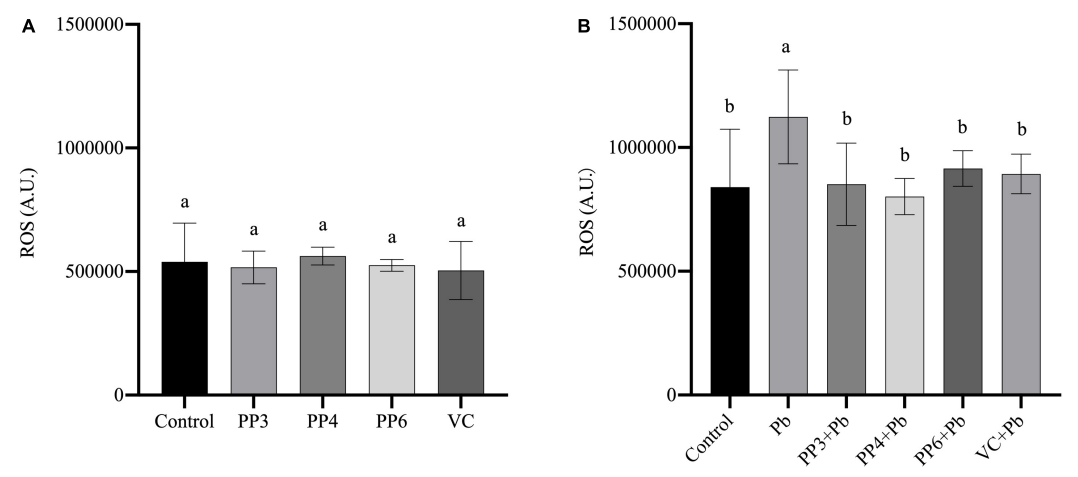
3、活性氧ROS水平的检测:根据文献选择80µM VC作为对照组评估豌豆肽抗氧化性能的标准(An et al., 2014)。使用200μM的PP3/4/6和80µM的VC处理PC12细胞4h,用试剂盒检测ROS水平,结果如图5A所示;使用200μM的PP3/4/6和80µM的VC预处理PC12细胞4h,再用10μM的Pb处理24h,用试剂盒检测ROS水平,结果如图5B所示。
图5 不同处理对PC12细胞内ROS的影响。(A)PP3、PP4、PP6和VC对PC12细胞内ROS的影响;(B)PP3、PP4、PP6和VC对Pb暴露PC12细胞内ROS的影响。柱状图的值表示平均值±SD(n≥3)。不同上标字母表示差异(P<0.05)。
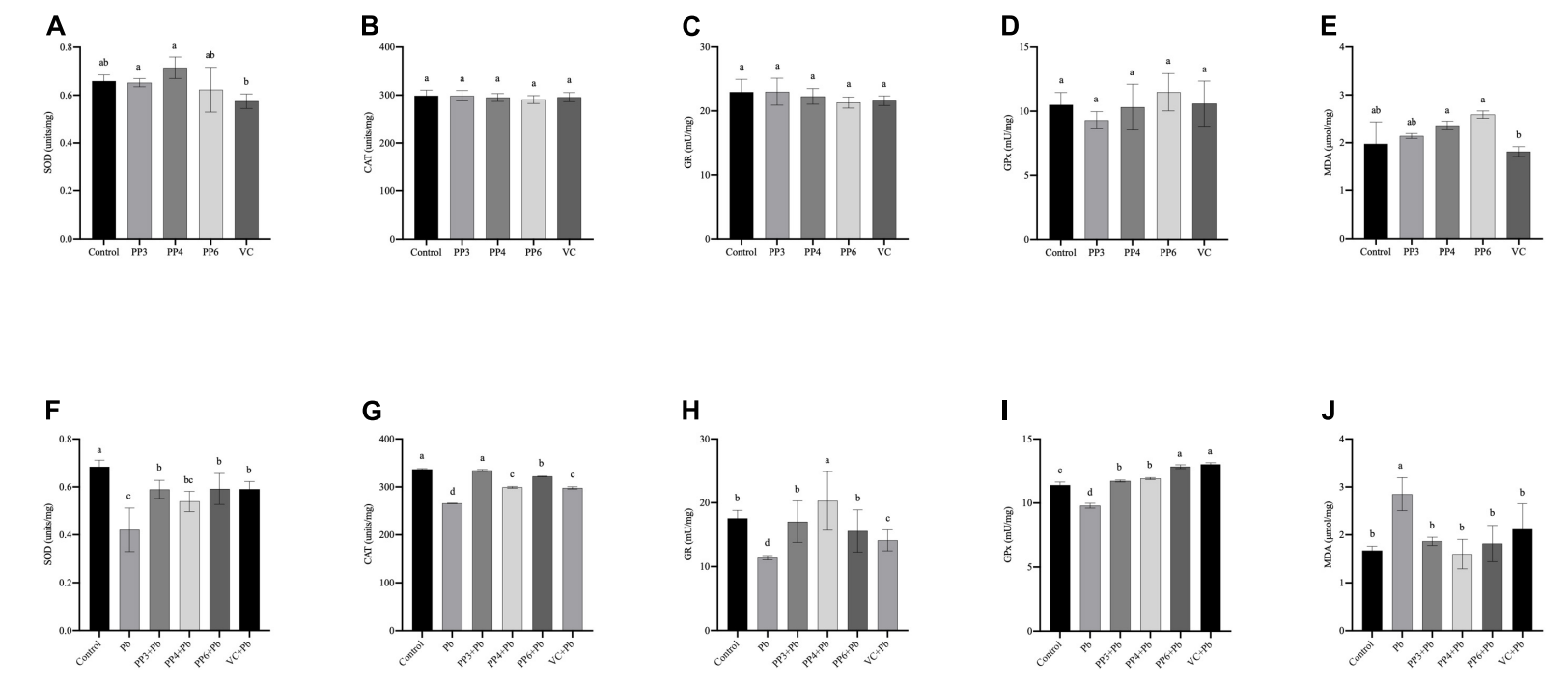
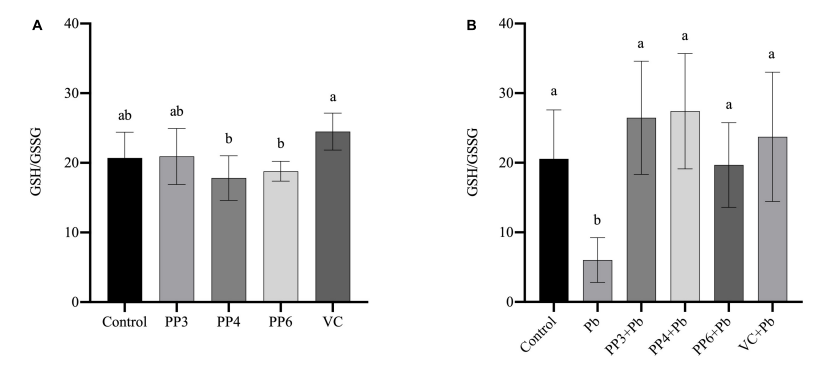
4、细胞氧化应激指标的检测:使用200μM的PP3/4/6和80µM的VC处理PC12细胞4h,用试剂盒检测抗氧化酶SOD、CAT、GR、GPx活性和丙二醛MDA含量,结果如图6A~E所示,检测GSH和GSSG水平,结果如7A所示;使用200μM的PP3/4/6和80µM的VC预处理PC12细胞4h,再用10μM的Pb处理24h,检测抗氧化酶SOD、CAT、GR、GPx活性和丙二醛MDA含量,结果如图6F~J所示,检测GSH和GSSG水平,结果如图7B所示。
图6 不同处理对PC12细胞氧化应激指标的影响。SOD结果如图(A、F)所示;CAT结果如图(B、G)所示;GR结果如图(C、H)所示;GPx的结果如图(D、I)所示;MDA的结果如图(E、J)所示。柱状图的值表示平均值±SD(n≥3)。不同上标字母表示差异(P<0.05)。
图7 不同处理对PC12细胞GSH/GSSG的影响。(A)PP3、PP4、PP6和VC对PC12细胞GSH/GSSG的影响;(B)PP3、PP4、PP6和VC对Pb暴露PC12细胞GSH/GSSG的影响。柱状图的值表示平均值±SD(n≥3)。不同上标字母表示差异(P<0.05)。
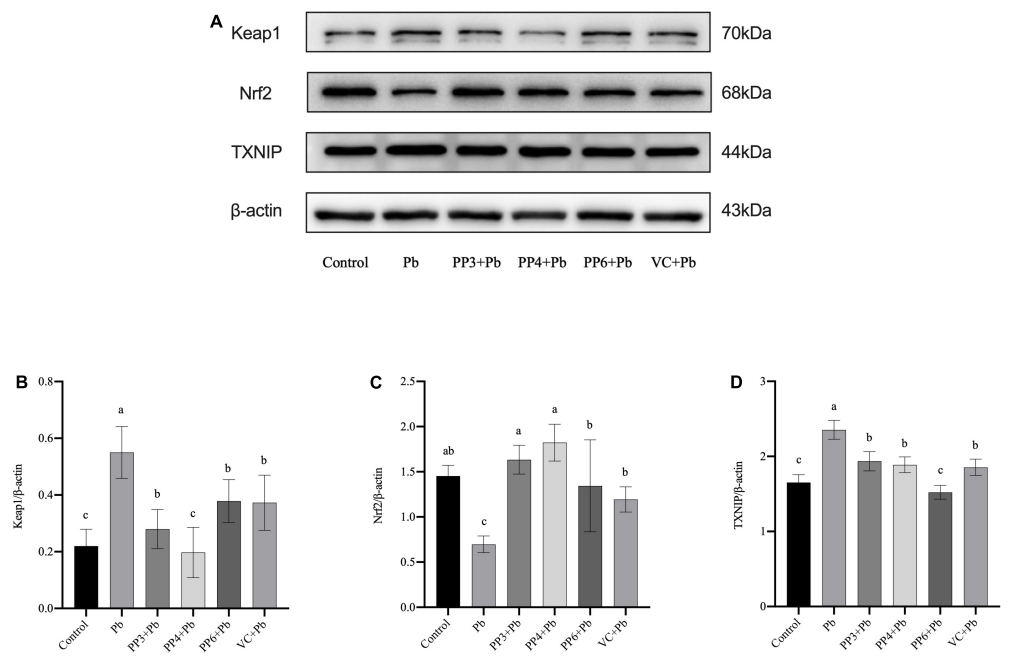
5.Western Blot:使用200μM的PP3/4/6和80µM的VC预处理PC12细胞4h,再用10μM的Pb处理24h,检测Keap1/Nrf2/TXNIP通路蛋白的表达。结果如图8所示。
Li H, Prairie N, Udenigwe CC, et al. Blood pressure lowering effect of a pea protein hydrolysate in hypertensive rats and humans. Journal of agricultural and food chemistry, 2011,59(18).
Li N, Wen L, Wang F, et al. Alleviating effects of pea peptide on oxidative stress injury induced by lead in PC12 cells via Keap1/Nrf2/TXNIP signaling pathway. Front Nutr. 2022;9:964938.
Liu JP, Qian YF, Qin GYX, et al. Antidiabetic activities of glycoprotein from pea (Pisum sativum L.) in STZ-induced diabetic mice. Food & function, 2021.
Lopes ACBA, Peixe TS, Mesas AE, et al. Lead Exposure and Oxidative Stress: A Systematic Review. Reviews of environmental contamination and toxicology, 2016,236.
Jiang X, Xing X, Zhang Y, et al. Lead exposure activates the Nrf2/Keap1 pathway, aggravates oxidative stress, and induces reproductive damage in female mice. Ecotoxicology and Environmental Safety, 2021,207.
Sarmadi BH, Ismail A. Antioxidative peptides from food proteins: A review. Peptides, 2010,31(10).
Su C, Shi A, Cao G, et al. Fenofibrate suppressed proliferation and migration of human neuroblastoma cells via oxidative stress dependent of TXNIP upregulation. Biochemical and Biophysical Research Communications, 2015,460(4).
Tang Z, Carrel M. The more things change the more they stay the same: Persistent spatial inequity in pediatric lead poisoning in Chicago. Applied Geography, 2022,142.
Utrilla MP, Peinado MJ, Ruiz R, et al. Pea (Pisum sativum L.) seed albumin extracts show anti-inflammatory effect in the DSS model of mouse colitis. Molecular nutrition & food research, 2015,59(4).
Zandi P, Schnug E. Reactive Oxygen Species, Antioxidant Responses and Implications from a Microbial Modulation Perspective. Biology (Basel). 2022;11(2):155.