如同人类的起源、繁衍与进化一般,肿瘤细胞虽然往往也源于同一个“祖先”,但随着其分裂、突变以及生长环境选择的作用,肿瘤细胞会形成许多不同谱系。这些在基因上既遗传相关,又存在一定差异的谱系,被称为亚克隆[1]。随着测序及组学技术的开展,越来越多的研究也证明了这一点[2]。
这些肿瘤亚克隆与邻近的免疫细胞、成纤维细胞以及细胞外基质等相互作用,共同构成复杂肿瘤微环境[3]。然而,不同的肿瘤亚克隆如何相互作用、如何塑造以及被肿瘤微环境塑造,仍有待进一步研究。此外,受限于基因组技术的局限,获取肿瘤细胞的遗传信息需要将肿瘤组织解离为单个细胞,从而失去了肿瘤细胞空间位置的信息[4]。
近日,来自欧洲生物信息学研究所的Moritz Gerstung、瑞典斯德哥尔摩大学的Mats Nilsson,以及英国桑格研究所的Lucy R. Yates国际团队,基于碱基特异性原位测序(BaSISS)方法,开发了首个可在完整肿瘤切片上识别不同亚克隆的方法。此外,通过结合多种组学技术,他们成功在两例乳腺癌患者的样本上,揭示了复杂的亚克隆空间形成与作用模式,相关研究成果发表于《自然》杂志[5]。
该研究发现,肿瘤中的不同亚克隆由于具有不同的遗传状态,往往具有不同的转录特征,同时可与肿瘤微环境相互作用,导致肿瘤内部的异质性。该方法对今后肿瘤耐药、转移等方面的研究具有重要价值。
论文首页截图
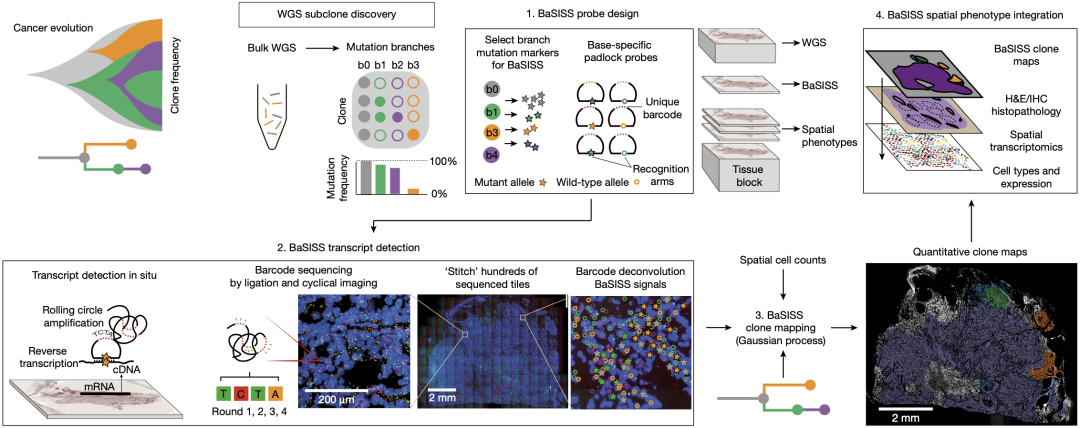
为了在保留细胞空间位置信息的情况下区分不同的肿瘤亚克隆,研究人员首先需要对一块组织进行全外显子测序(WGS),以识别具有不同基因突变特征的肿瘤亚克隆群体。
紧接着,根据这些特征设计相应的探针在肿瘤切片上进行原位检测,进而得到包含细胞空间定位的亚克隆图谱。此外,将所获得的肿瘤亚克隆图谱结合免疫组化、空间转录组等进行分析,可了解肿瘤亚克隆之间以及与周围环境的相互作用。
研究流程示意图
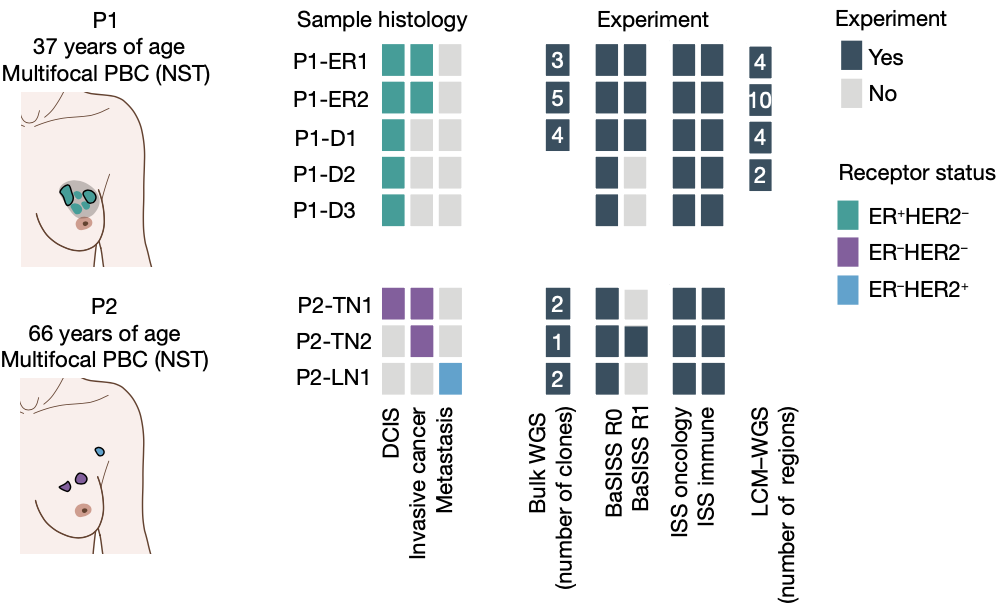
研究团队采用上述方法对两例乳腺癌患者(P1和P2)的8个肿瘤组织块进行了分析。
P1患者肿瘤组织病理类型大体为导管原位癌(DCIS),但在其肿瘤组织内还有2个独立生长的原发性浸润性乳腺癌(PBC;ER阳性、HER2阴性),研究人员共使用了来自DCIS的3个区域的样本(P1-D1、P1-D2和P1-D3)和来自PBC的2个样本(P1-ER1和P1-ER2)。
P2为三阴性乳腺癌患者(ER、孕激素受体和HER2表达均为阴性),研究人员使用了2个PBC样本(P2-TN1和P2-TN2)和1个转移的腋窝淋巴结样本(P2-LN1)。
研究中的样本信息
为了证明BaSISS方法的有效性和可行性,研究人员首先关注来自P1的3个样本(P1-ER1、P1-ER2和P1-D1)。
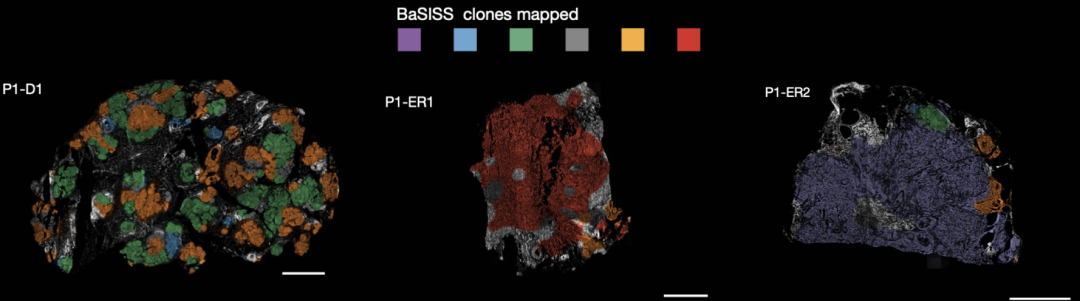
WGS结果显示,这3个样本中共存在6个突变簇,且这6个突变簇在3个样本中分布不均。紧接着,将针对这6个突变簇的51个等位基因设计的探针在切片上进行原位检测,结果证实确实可在原位识别出这6个肿瘤亚克隆。
在肿瘤切片原位识别6个亚克隆(P1-紫色、P1-红色、P1-灰色、P1-橙色、P1-绿色和P1-蓝色)
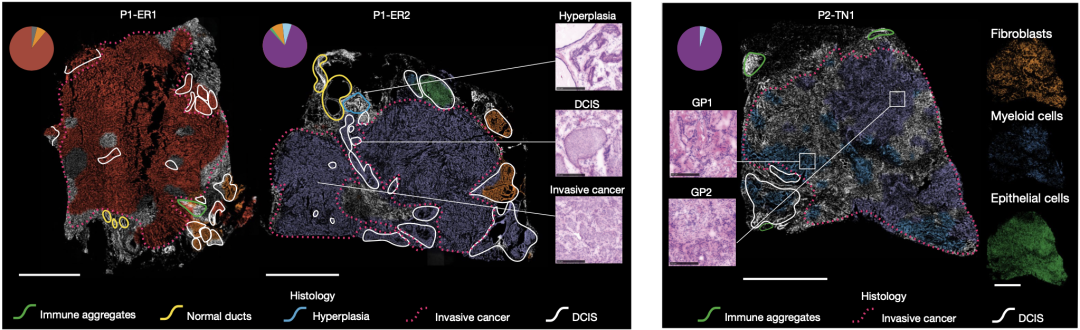
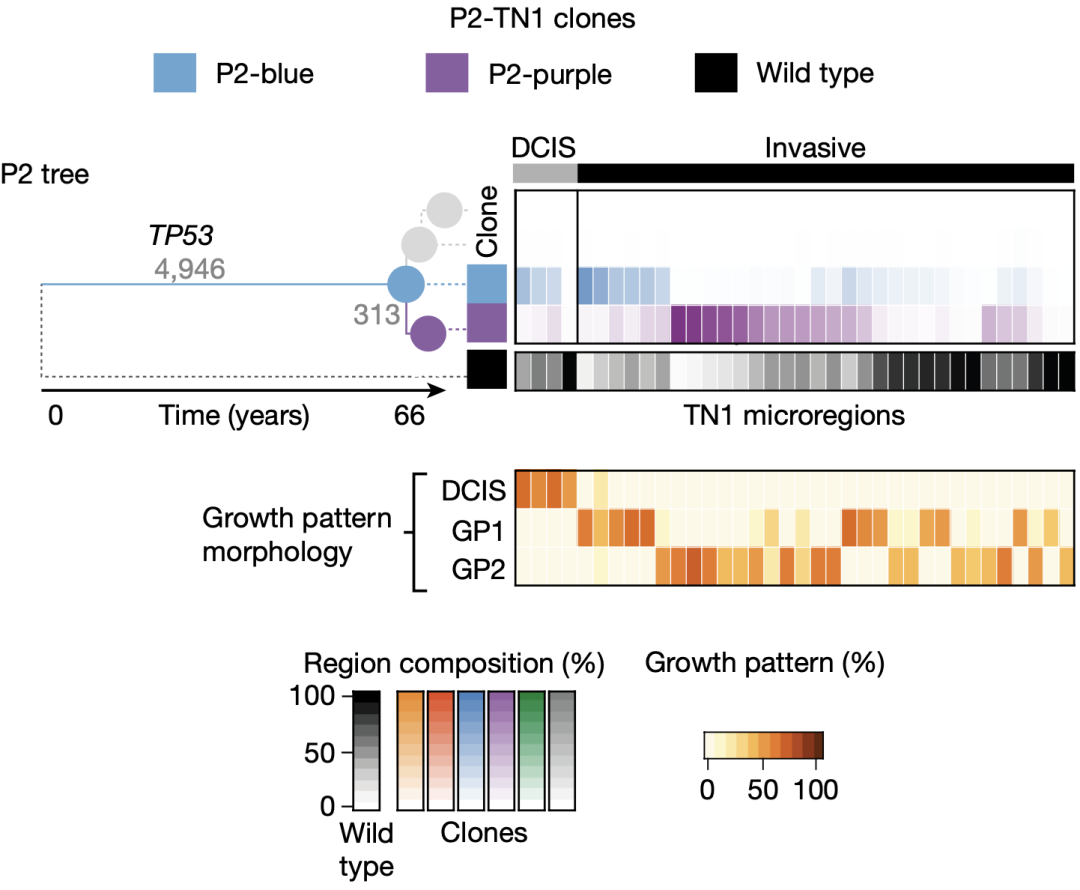
众所周知,一块肿瘤组织中常常存在处于发展不同阶段的肿瘤细胞,如许多PBC同时含有浸润性癌和混合型DCIS。为了研究肿瘤亚克隆与肿瘤发展阶段的关系,研究人员对3个具有浸润性癌和混合型DCIS的PBC样本(P1-ER1、P1-ER2和P2-TN1)进行研究。
在原位切片中,P1-ER1和P1-ER2由6个亚克隆组成,P2-TN1由2个亚克隆组成,可以明显看出亚克隆的空间模式与组织学进展状态相关。研究人员还注意到,聚集的免疫细胞、正常的导管及增生区域并不会被识别为肿瘤亚克隆,而表现出浸润生长的肿瘤细胞主要来自新近分化的亚克隆(P1-ER1中的P1-红色、P1-ER2中的P1-紫色和P2-TN1中的P2-紫色)。相比之下,早期分化出的亚克隆完全或部分处于组织学浸润前病变中。
P1-ER1、P1-ER2和P2-TN1中亚克隆与组织学进展状态的关系
然而,研究人员同时发现,在每个PBC中,均存在跨DCIS和浸润性癌存在的亚克隆,如P1-ER1中的P1-红色和P1-ER2中的P1-紫色,表明遗传状态和组织学状态的关系十分复杂。
接下来,研究人员通过整合空间转录组的数据,探究了肿瘤细胞表型变化如何与遗传状态和组织学状态转变相关。
在P1-ER1和P1-ER2中,与更具增殖性的表型一致,PTEN突变克隆区域表现出比PTEN野生型区域更密集的Ki-67核染色(表明增殖更旺盛)。但是,对于给定的基因型克隆,无论其处于原位癌还是浸润性癌的状态,其Ki-67评分都是相似的。这表明Ki-67表达的上调在时间上与PTEN突变的获得有关,且发生在肿瘤浸润之前。
此外,两个遗传上不同的亚克隆,即使都处于浸润性癌区域,两者的表型也会存在一定差异。例如P2-TN1中的P2-蓝色和P2-紫色,这两个亚克隆表现出不同的形态学特征,其周围的基质与免疫细胞密度也明显不同,基因转录同样存在明显差异。这些结果表明,不同亚克隆由于遗传状态的不同,其表型存在差异,而且会和肿瘤微环境产生相互作用。
肿瘤细胞表型变化与遗传状态和组织学状态转变相关
通过对亚克隆空间信息的分析,还可推测哪种亚克隆更容易发生转移。
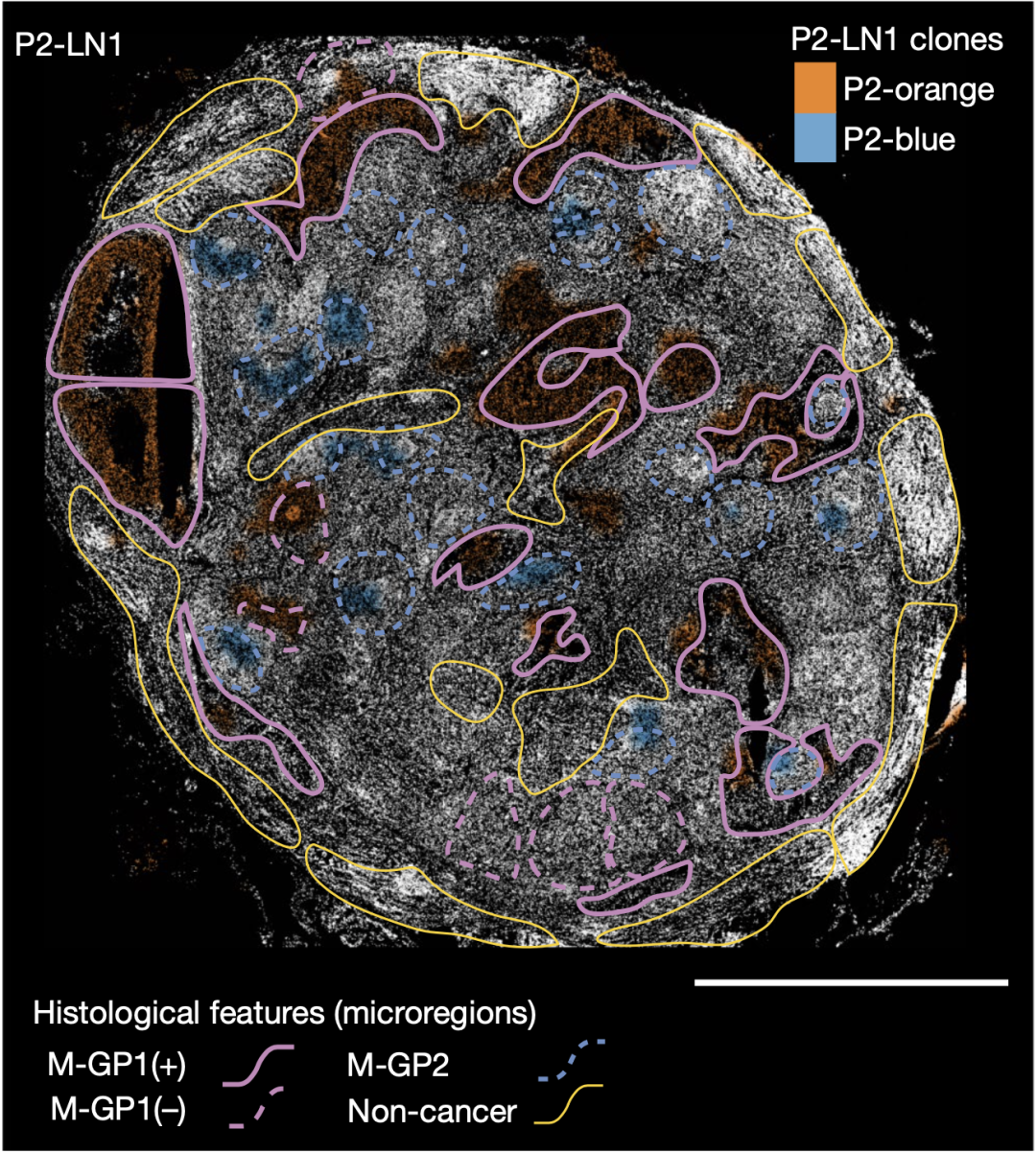
研究人员对来自P2的淋巴结转移样本(P2-LN1)进行分析发现,P2-LN1中存在2种亚克隆(P2-蓝色和P2-橙色),而在P2原发性肿瘤(P2-紫色和P2-蓝色)中能检测到P2-蓝色。因此不难看出,P2-蓝色是更可能发生转移的那一个亚群。
P2-LN1中存在2种亚克隆
即使同为转移灶处的肿瘤,P2-蓝色和P2-橙色亚克隆也展现出截然不同的生存模式。结合HE和免疫组化染色结果,P2-橙色亚克隆常位于淋巴窦内,而P2-蓝色亚克隆细胞较为分散,周围常聚集着免疫细胞团。
整合空间转录组学数据后研究人员还发现,相对于P2-橙色亚克隆,P2-蓝色亚克隆位于富含T细胞和B细胞的区域,具有与适应性免疫系统的潜在相互作用;相比之下,P2-橙色亚克隆主要位于淋巴窦内,周围的大多数免疫细胞是髓系细胞,而且P2-橙色亚克隆具有更多的缺氧特征(表达更高的VEGFA)。
这些结果表明转移性肿瘤内部也存在异质性,这种异质性可能源自于转移细胞本身,也可能是转移后与转移灶环境相互作用的结果。
总的来说,本研究开发了首个可在人体组织中刻画多个肿瘤亚克隆的方法,有利于全面了解肿瘤的发展过程。
肿瘤细胞存活和扩散的原因不仅仅是基因变化,还可能与其所处空间特征有关。该方法将有助于在今后通过识别耐药与转移亚克隆肿瘤的空间特征,为肿瘤的治疗开辟新途径。
参考文献
1.Gerstung M, Jolly C, Leshchiner I, Dentro SC, Gonzalez S, Rosebrock D, Mitchell TJ, Rubanova Y, Anur P, Yu K et al: The evolutionary history of 2,658 cancers. Nature 2020, 578(7793):122-128.
2.Andor N, Graham TA, Jansen M, Xia LC, Aktipis CA, Petritsch C, Ji HP, Maley CC: Pan-cancer analysis of the extent and consequences of intratumor heterogeneity. Nat Med 2016, 22(1):105-113.
3.Junttila MR, de Sauvage FJ: Influence of tumour micro-environment heterogeneity on therapeutic response. Nature 2013, 501(7467):346-354.
4.Gaglia G, Kabraji S, Rammos D, Dai Y, Verma A, Wang S, Mills CE, Chung M, Bergholz JS, Coy S et al: Temporal and spatial topography of cell proliferation in cancer. Nat Cell Biol 2022, 24(3):316-326.
5.Lomakin A, Svedlund J, Strell C, Gataric M, Shmatko A, Rukhovich G, Park JS, Ju YS, Dentro S, Kleshchevnikov V et al: Spatial genomics maps the structure, nature and evolution of cancer clones. Nature 2022.
文章来源:奇点网