根据细胞种类的不同细胞培养分为原代培养和传代培养。根据细胞生长特点的不同又可分为贴壁培养和悬浮培养。
原代培养是指直接从组织中分离下来的细胞,放在细胞培养瓶或培养皿中培养的过程。
而当细胞不断生长繁殖,细胞间相互紧贴,空间小,密度大,营养物质不足以及代谢物累积,导致细胞生长速度缓慢,状态变差甚至死亡,因此需要传代培养来避免这种情况的发生。
传代培养即将细胞消化稀释,分装到两个或两个以上的培养瓶或培养皿中使之继续生长的过程。
一般认为原代细胞是指从原代培养的第1代传至第10代的细胞;细胞系为原代细胞首次传代成功的细胞;细胞株则是传代培养过程中培养的第10代至第50代细胞,其遗传物质较原代细胞发生改变,具有无限增殖的能力。
贴壁培养是指贴壁依赖型细胞贴附在一定固相表面进行生长繁殖的过程。
悬浮培养是指某些不具有贴壁生长特性的细胞,只能在可流动的液体培养基里生长繁殖的过程。
原代培养的操作步骤为:取材→分离→培养。
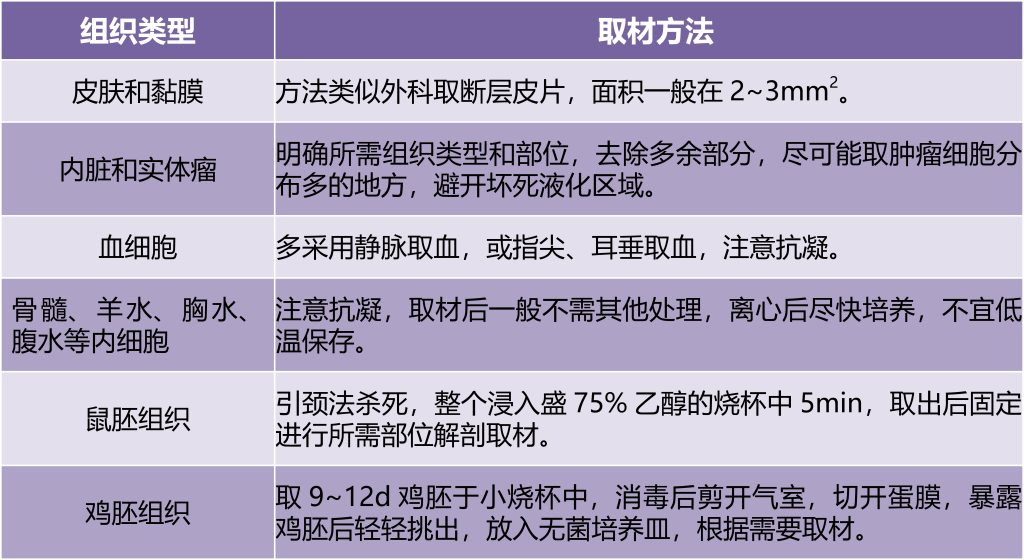
(1)取材:对于不同的组织有不同的取材方法(Uysal et al., 2018;司徒镇强,吴军正., 2007)具体见表1,但均应保持材料的新鲜及严格无菌。
表1 不同组织的取材方法
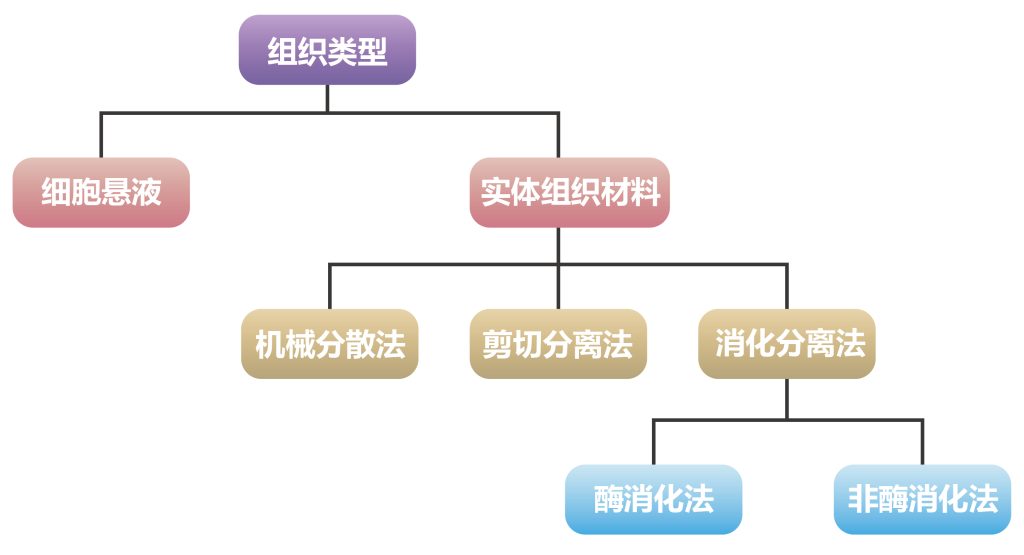
(2)分离:不同的组织类型采用不同的分离方法(Uysal et al., 2018;司徒镇强,吴军正., 2007)具体见图1与表2。
图1 不同组织类型分离方法
表2 各种分离方法操作要点
(3)培养:原代细胞的培养方法分为组织块培养法、消化培养法、悬浮细胞培养法和器官培养。前两种是最简单、常用、成功率高的方法。根据不同分离方法取得的细胞接种到培养瓶后,放置于37℃ CO2培养箱中培养。
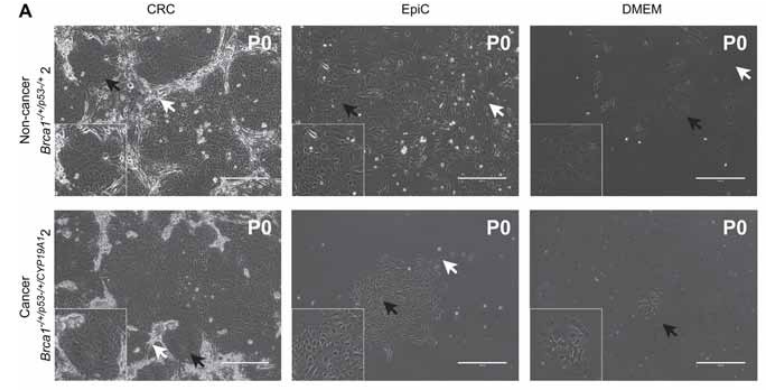
图2 小鼠原代乳腺上皮细胞在不同培养基中的培养状态(Alamri et al., 2016)。
2.1 贴壁培养
细胞传代培养操作步骤如下:
(1)传代前在倒置显微镜下观察细胞形态和生长密度,当细胞生长密度达到80%~90%时,即可进行传代。
(2)吸掉或倒掉培养瓶内的培养液。加入PBS清洗1~2次,左右轻轻摇晃后弃掉。
(3)根据培养瓶大小向瓶内加入适量含EDTA的胰蛋白酶,一般应覆盖整个培养瓶底。
(4)把培养瓶放入37℃ CO2培养箱进行消化,2~5min后拿出放在倒置显微镜下进行观察,当发现有70%~80%细胞收缩变圆、细胞间隙变大时,再轻轻拍打培养瓶使剩余细胞脱落,然后立即加入2倍胰蛋白酶量的培养液中止消化,使用吸头轻轻吹打,混合均匀,以防消化过度。
(5)吸出所有细胞悬液至离心管内,1000rpm/min离心3~5min。
(6)弃上清,加入适量培养液重悬细胞,轻轻吹打混匀,使细胞均匀分散。
(7)用吸头吸取适量细胞悬液,以适宜的密度接种于新的培养瓶中,补足培养液,摇匀,放置于37℃ CO2培养箱中进行培养。
(8)根据细胞生长状态确定换液或传代时间,甚至进行细胞冻存。
2.2 悬浮细胞
传代培养操作步骤如下:
一般实验室中悬浮细胞传代方法分为直接传代法和离心传代法(培养液中含有细胞碎片的情况下)。当在显微镜下观察到悬浮细胞已经长满至80%~90%(细胞悬液变黄)时,即可进行传代。
2.2.1 直接传代法:
(1)显微镜下观察到细胞状态良好,基本无细胞碎片。
(2)立起细胞瓶使细胞自然沉降,用吸头吸取1/2~2/3细胞上清液,弃掉。
(3)加入新鲜培养液重悬细胞,以适宜的密度接种于新的培养瓶中,补足培养液,摇匀,放置于培养箱中进行培养。
2.2.2 离心传代法:
(1)用吸头吸取全部细胞悬液至离心管内,1000rpm/min离心3~5min。
(2)弃上清,加入适量培养液重悬细胞,轻轻吹打混匀,使细胞均匀分散。
(3)用吸头吸取适量细胞悬液,以适宜的密度接种于新的培养瓶中,补足培养液,摇匀,放置于培养箱中进行培养。
(1)选取对数增生期的细胞,按照传代的方法清洗、消化和离心。
(2)离心后弃掉上清,以适宜的密度加入适量的无血清冻存液重悬,混匀。
(3)分装到无菌冻存管中,每管1.5mL。
(4)用封口膜封好,并做好标记,放入液氮罐或-80℃冰箱中保存。
(1)取出冻存管,迅速放入37℃水浴锅中,使其快速融化。擦干消毒后在超净工作台内继续操作。
(2)打开盖子,吸出细胞悬液到离心管中,再加入2倍细胞悬液量的培养液混匀。
(3)1000rpm/min离心3~5min。
(4)弃上清,加入适量培养液重悬细胞,轻轻吹打混匀,使细胞均匀分散。
(5)用吸头吸取适量细胞悬液,以适宜的密度接种于一个或多个培养瓶中,补足培养液,摇匀,放置于培养箱中进行培养。
(6)次日于显微镜下观察细胞形态和生长状况,根据情况进行换液或传代。之后就按常规培养进行。
(2)所用培养液必须适宜细胞生存和生长。来源于不同动物种类、组织类型的细胞,对培养液的要求不一样,必要时可用预实验的方法选择适当的培养液。
(3)胎牛血清对于维持细胞生存,促进细胞生长起着关键作用。可根据文献或预实验选择合适的胎牛血清。—旦确定,就应保持用至实验完成。
(4)消化细胞时应避免消化时间过短导致消化不完全,收集到的细胞数量少,或消化时间过长导致细胞成团块样絮状游离,这时的细胞已有损伤或死亡,影响细胞数量和实验进度。
(5)细胞离心的时候应避免离心力过小收集的细胞数量不够,或离心力过大对细胞产生损伤。离心后的细胞沉淀弃去上清后,应先弹散细胞沉淀,再加入培养液重悬,这样比直接吹打对细胞损伤小,可以提高细胞活率。
Refresh cell culture. Nat Biomed Eng. 2021 Aug;5(8):783-784.
Uysal O , Sevimli T , Sevimli M , et al. Cell and Tissue Culture: The Base of Biotechnology Science Direct[J]. Omics Technologies and Bio-Engineering, 2018:391-429.
司徒镇强,吴军正. 细胞培养[M].世界图书出版公司:, 200701.356.