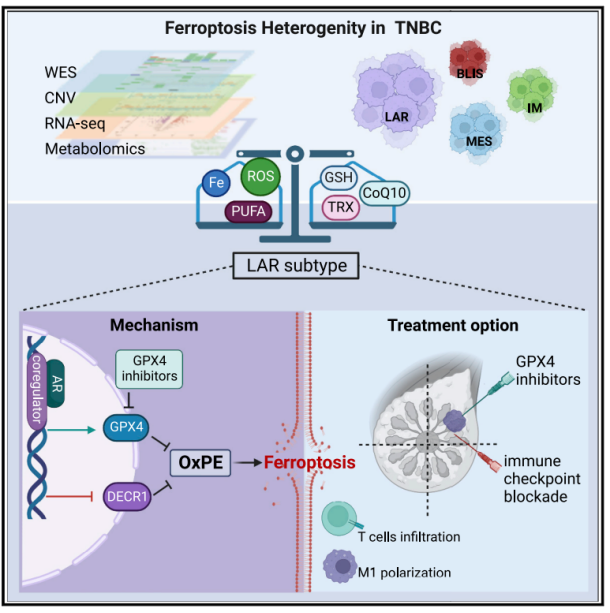
作为最难治疗的乳腺癌亚型,三阴乳腺癌(triple-negative breast cancer,TNBC)是一种生物学上和临床上具有异质性的疾病,至今尚缺乏有效的治疗干预手段。由于TNBC是一类富含铁且富脂质的肿瘤,所以诱导铁死亡成为值得探索的治疗策略。今天向大家分享一篇复旦大学团队的研究成果(就是那个将TNBC进一步分为若干亚型的团队),近期发表于《Cell Metabolism》(2022年IF=31.373,JCR分区=Q1),文章名为:“Ferroptosis heterogeneity in triple-negative breast cancer reveals an innovative immunotherapy combination strategy”。
该研究系统地综合分析TNBC的铁死亡异质性,并着重强调:
1)TNBC的管腔雄激素受体(luminal androgen receptor,LAR)亚型对铁死亡诱导剂,特别是谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)抑制剂异常敏感;
2)雄激素受体(androgen receptor,AR)双重调控LAR肿瘤的铁死亡;
3)GPX4抑制剂联合免疫疗法是治疗LAR肿瘤的新型策略。
1.整理大型TNBC队列(cohort)的多组学数据(multiomics data),研究细胞铁死亡。
2.TNBC的异质性表型包含铁死亡相关的代谢物和代谢途径。
3.TNBC的管腔雄激素受体(LAR)亚型的特征包括氧化磷脂酰乙醇胺(oxidized phosphatidylethanolamines)上调和谷胱氨酸代谢(特别是GPX4)上调,其促使GPX4抑制剂诱导铁死亡。
4.GPX4抑制剂不仅诱导肿瘤的铁死亡,还增强抗肿瘤免疫。
5.相比于单药治疗,GPX4抑制剂和PD-1抗体(anti-PD-1)的联合运用产生更好的治疗效果。
6.临床诊断的结果显示为:免疫治疗组的患者中,GPX4的高表达量与低细胞溶解分数和不良预后显著相关。
7.本研究阐述了TNBC铁死亡图谱,并采用免疫疗法的组合策略治疗LAR肿瘤。
1.明确TNBC亚型中铁死亡相关特点的异质性
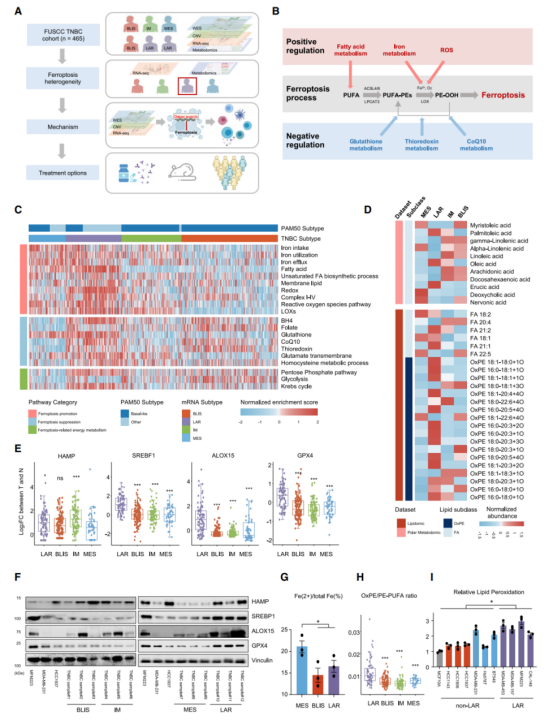
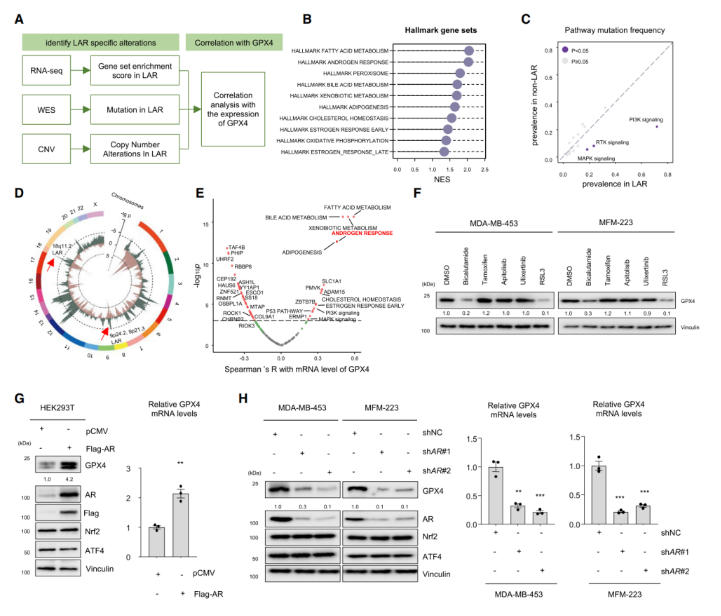
作者使用多组学的TNBC数据集(n=465),其中,360份样本含有转录组数据,279份样本含有全外显子组测序(WES)相关的结果,401份样本含有肿瘤体细胞上的拷贝数变化(SCNA)数据,以及330份样本含有代谢组学数据(图A)。鉴于铁死亡和细胞代谢的连接强度(图B),使用数据集中转录组学和代谢组学的数据推断TNBC亚型——间质型(MES)、管腔雄激素受体型(LAR)、免疫调节型(IM)和基底样免疫抑制型(LAR)的铁死亡活性,也利用单样本基因集富集分析(ssGSEA)计算20类铁死亡相关代谢途径的富集程度(图C&D)。此外,对比TNBC亚型中大量铁死亡相关的代谢物——其包括氧化性磷脂酰乙醇胺(OxPE)和脂肪酸(FA)(图D)。另外,结果显示MES亚型有类似于乳腺癌干细胞的特点(图C)。而在mRNA和蛋白质水平上,MES亚型展现为较低的HAMP表达,即铁平衡的负调节因子(图E&F)。在TNBC的细胞系中,也验证了铁代谢在MES中的调节异常(图G)。另一方面,软脂油酸和十八烯酸促进T细胞触发的铁死亡,其含量在LAR肿瘤中显著上升(图D&图H),而LAR亚型的脂质过氧化水平显著提高(图I)。总之,TNBC亚型显示出与铁死亡途径相关的特征。
2.明确GSH代谢显著抑制LAR肿瘤的铁死亡
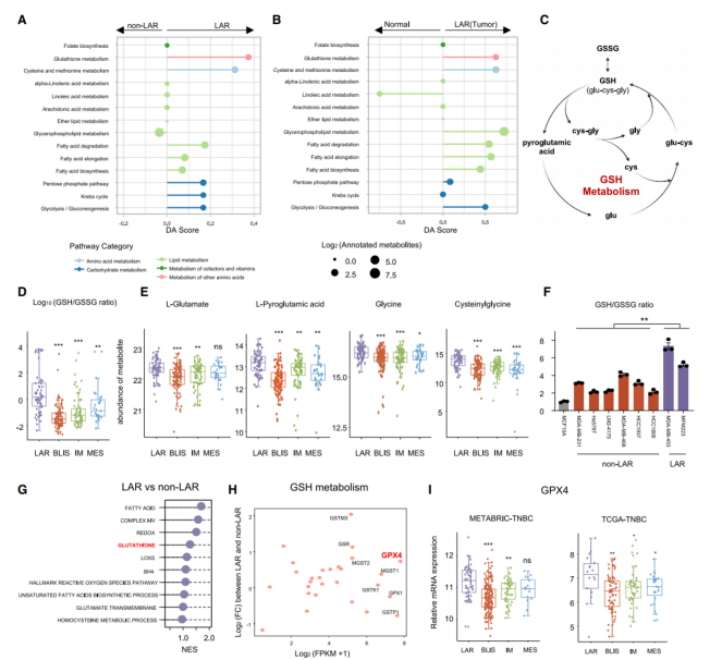
对比非LAR的肿瘤和正常组织后,结果显示:GSH(谷胱甘肽)代谢显著地抑制铁死亡(图A&B)。GSH是肿瘤细胞中一种主要的小分子抗氧化剂,其由半胱氨酸、谷氨酸盐和甘氨酸形成(图C)。对比GSH循环中核心代谢物的含量时,发现GSH相关的代谢物——比如L-胺酸、L-氧化脯氨酸、甘氨酸和半胱氨酰甘氨酸——在LAR肿瘤中显著提高(图D&E)。在TNBC细胞系中,也发现了LAR型细胞的GSH/GSSG高比率(图F),且GSH代谢是LAR亚型中必不可少的抑制铁死亡的通路(图G)。此外,在GSH通路的代谢基因中,LAR肿瘤与非LAR肿瘤间GPX4表达具有显著差异(图F&H&I)。综上所述,GPX4是GSH代谢中潜在的决定因素,在LAR肿瘤中抑制铁死亡。
3.对多种铁死亡诱导剂独特的敏感性强调GPX4在LAR肿瘤中的重要性
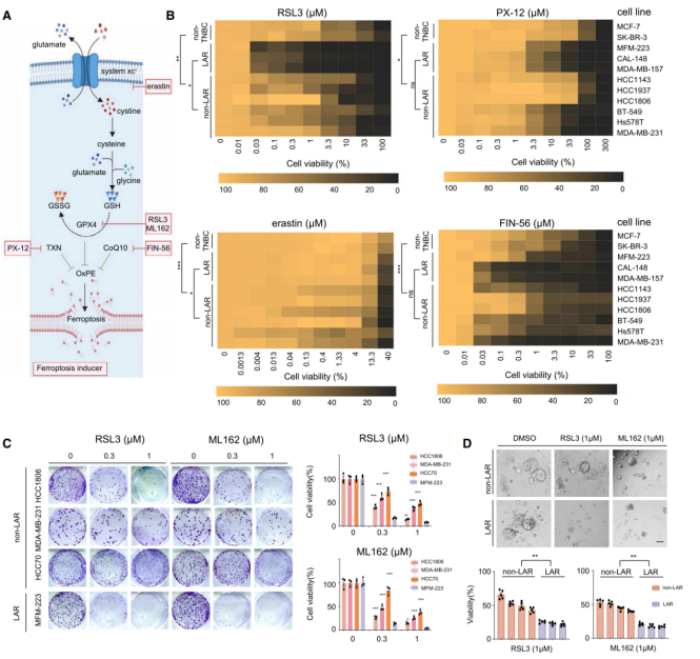
铁死亡诱导剂包括erastin、PX-12、FIN-56、RSL3和ML162(GPX4抑制剂),本研究将这些诱导剂分别处理LAR、非LAR和非TNBC细胞系,并评估它们诱导细胞铁死亡的效果(图A)。经IC50实验结果显示,GPX4对LAR肿瘤中的铁死亡体内平衡至关重要(图B)。细胞克隆形成实验进一步确认,LAR肿瘤细胞对GPX4抑制剂的灵敏度最高(图C)。
4.AR调控LAR肿瘤中GPX4的表达量
通过整合基因组和转录组分析比较LAR和非LAR肿瘤后发现,LAR特定的改变与GPX4的表达量呈显著相关性(图A)。GSEA结果显示:在LAR肿瘤中,特征基因的一些通路被激活,譬如脂肪酸代谢通路、雄激素反应通路和过氧物酶体通路(图B)。基因组分析表明:在LAR中,磷脂酰肌醇-4,5-二磷酸3-激酶(PI3K)信号、受体酪氨酸激酶(PTK)信号和丝裂原活化蛋白激酶(MAPK)通路发生突变,而9p21.3、9p24.2和18q11.2均缺失(图C&D)。Spearman相关性分析显示:脂肪酸新陈代谢、胆汁酸代谢、雄激素反应、脂肪形成、胆固醇内稳态、PI3K信号突变、MAPK信号突变和溶质运载蛋白家族1成员1(SLC1A1)的表达与GPX4的表达量呈正相关(图E)。此外,AR抑制剂(比卡鲁胺)和GPX4抑制剂(RSL3)明显降低GPX4的蛋白水平(图F)。而HEK293T细胞中过表达AR导致GPX4的mRNA和蛋白水平显著增加,而抑制AR的表达水平显著降低MDA-MB-453细胞和MFM-223细胞中GPX4的表达量(图G&H)。总之,AR调控LAR肿瘤中GPX4的表达水平。
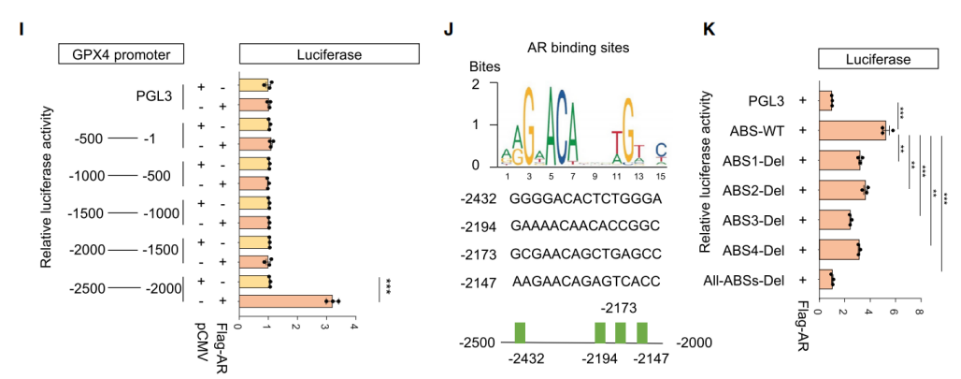
5.AR结合GPX4的启动子并激活其表达
在转录水平上,AR上调GPX4的表达量(图G&H)。荧光素酶报告基因实验显示,GPX4仅-2500 bp~-2000 bp的区域结合AR并上调荧光素酶信号(图I)。比对该区域的AR结合部位(ABSs)后,发现AR识别4个基序(图J),这些基序的突变抑制AR诱导的转录上调(图K)。总而言之,AR结合GPX4的启动子,并提升GPX4的表达量。
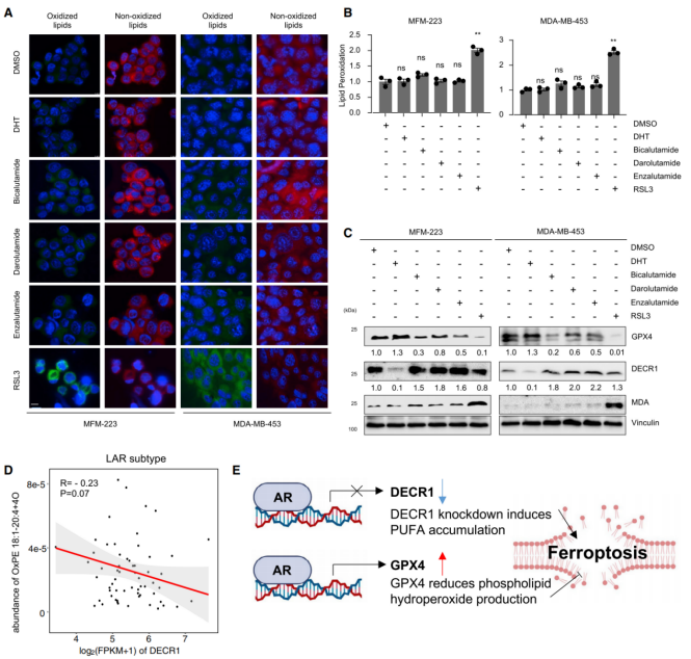
6.AR调控铁死亡的双重角色暗示:相比于靶向AR,靶向GPX4对LAR的TNBC患者更为重要
不同于AR的抑制剂,GPX4的抑制剂提高脂质过氧化的水平,并促进铁死亡(图A&B)。此外,暴露于GPX4抑制剂后,脂质过氧化的生物标记物(即丙二醛)上调(图C)。另外,AR上调多不饱和脂肪酸(PUFA)生物合成,促进铁死亡;且AR会上调GPX4的表达,从而清除铁死亡过程中的脂质过氧化(图E)。因此,抑制GPX4使LAR肿瘤细胞发生铁死亡。
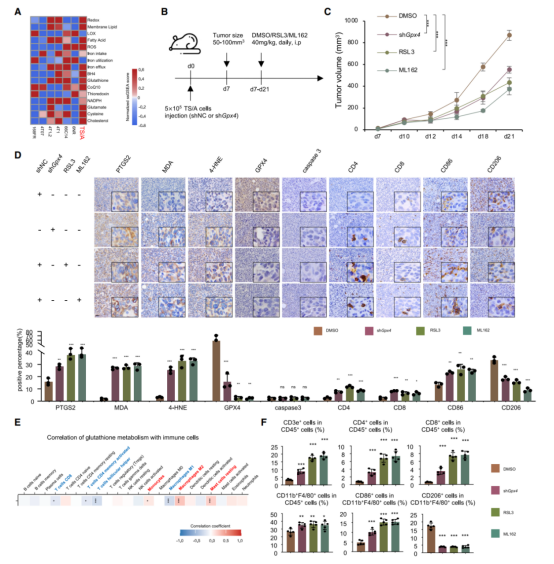
7.GPX4抑制剂减缓肿瘤生长,并对体内的肿瘤微环境进行重编程
TS/A是鼠的LAR肿瘤细胞系,其铁死亡相关通路富集,且在以往研究中已证明是LAR亚型(图A)。下调GPX4的表达量显著诱导肿瘤中的铁死亡,而非凋亡(图C&D)。根据免疫组化染色的结果,抑制GPX4显著提升环加氧酶2(PTGS2)、丙二醇(MDA)和4-羟基壬烯醛(4-HNE)含量(图D)。相关性分析显示:GSH代谢与CD8+ T细胞/M1型巨噬细胞的比率呈负相关,而GSH代谢与M2型巨噬细胞/静止肥大细胞的比率呈正相关(图E)。综上所述,抑制LAR肿瘤的GPX4表达量显著促进铁死亡、减缓肿瘤生长且引发肿瘤微环境重编程,从而获得炎性表型。
8.GPX4抑制剂联合免疫检查点阻断(ICB)能有效治疗生物学特性类似LAR的肿瘤
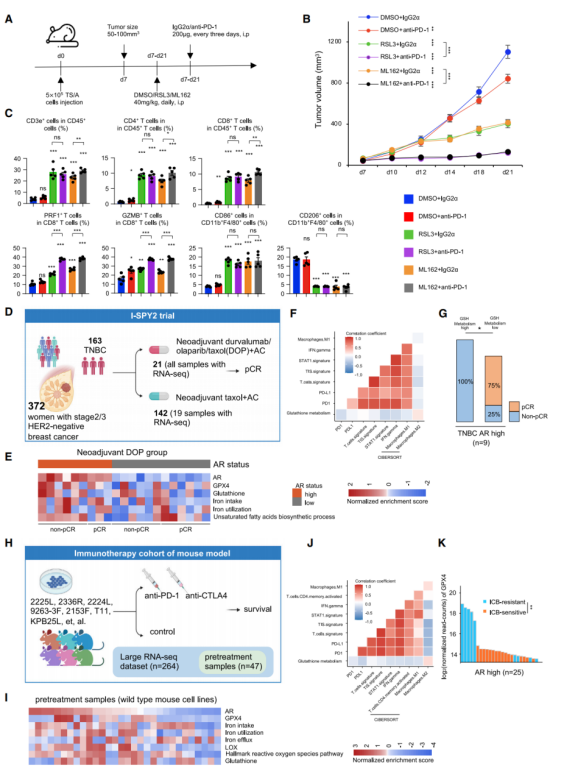
使用GPX4抑制剂或阻断程序性细胞死亡蛋白1(PD-1)治疗小鼠(图A)后发现:对比于单药治疗,GPX4抑制剂和抗PD-1抗体的联合治疗更有效阻止肿瘤增长(图B)。根据流式细胞术结果发现,该联合治疗诱导强烈的免疫反应,且PRF1+ CD8+ T细胞/GZMB+ CD8+ T细胞的比率大幅升高(图C)。此外,21位TNBC患者接受新辅助免疫治疗,并对其肿瘤样本进行转录组分析(图D)。高AR表达量的TNBC患者呈现铁代谢提高,且不饱和脂肪酸代谢和GSH代谢活力上升(图E)。其中,GSH新陈代谢和肿瘤炎症、STAT1、IFN-γ、PD-1表达量和M1型巨噬细胞的比例呈负相关,但与M2型巨噬细胞的比例呈正相关(图F)。不仅如此,在AR高表达组,GSH新陈代谢的提高与缺少病理学完全缓解(qCR)显著相关(图G)。而类似于LAR肿瘤,AR表达量较高的肿瘤显示相似的生物学特性(图H&I)。同样,GSH代谢与免疫相关的生物标记物呈负相关(图J)。另外,对比GPX4表达量和单个鼠细胞系对免疫治疗的反应后发现:ICB治疗抵抗的小鼠GPX4表达量更高(图K)。总之,在生物特征上,联合GPX4抑制剂和ICB适用于治疗类似LAR的肿瘤。
此研究结合TNBC患者的代谢组学、转录组学和基因组学,从而系统地挖掘出TNBC亚型中异质性TNBC的铁死亡表型。基于多组学数据和药物反应实验,本研究确定LAR是一类三阴性乳腺癌的亚型,其对铁死亡极其敏感;此外,GPX4对调控LAR肿瘤的铁死亡至关重要。在GPX4和PUFA的上游,AR参与铁死亡的双重过程。另一方面,联合GPX4和ICB有益于治疗类似于LAR的生物学特性的肿瘤。然而,本研究存在一定的局限性。首先,本研究需要进一步鉴定临床实践中联合GPX4抑制剂和ICB的治疗效果。其次,铁死亡的代谢调节剂并非是从TNBC多组学数据的相关分析得出的,此处无法排除其他调节机制的影响。最后,由于人体的LAR细胞系具有极有限的致瘤潜能,所以起源于鼠细胞的异种移植进行的GPX4抑制剂单药治疗无法完全代表体内的抗肿瘤活性。