据世界卫生组织(WHO)估计,如果当前吸烟趋势继续下去,到21世纪末,将有超过10亿人过早死亡(Kheradmand et al., 2022)。值得注意的是,虽然吸烟是COPD最常见的危险因素,使得戒烟计划成为预防COPD的关键因素,但吸烟也并不是唯一的危险因素,流行病学研究的一致证据表明,不吸烟的人也可能会发展为COPD,其他因素包括:室内或室外超细颗粒、职业接触某些化学品、吸入臭氧以及慢性呼吸道感染等等(图2)。
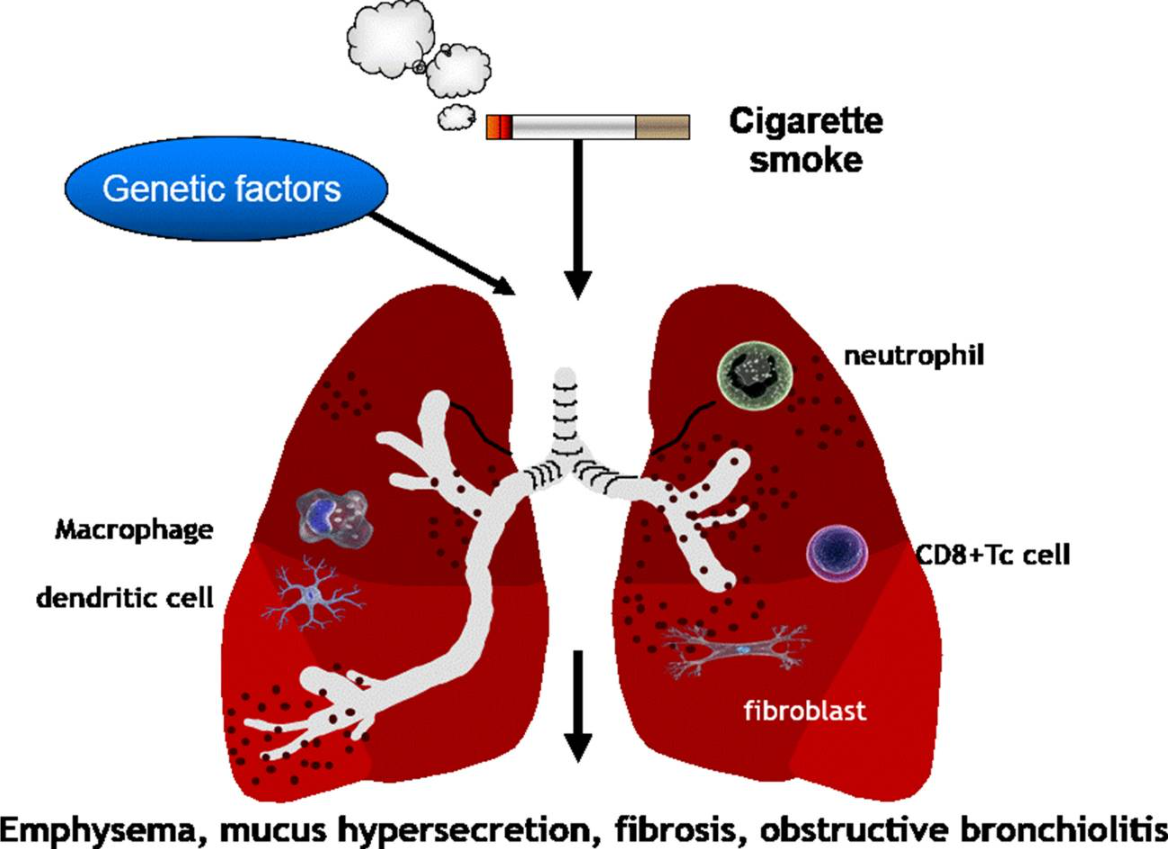
图4 COPD发展机制与免疫(Bagdonas et al., 2015)。
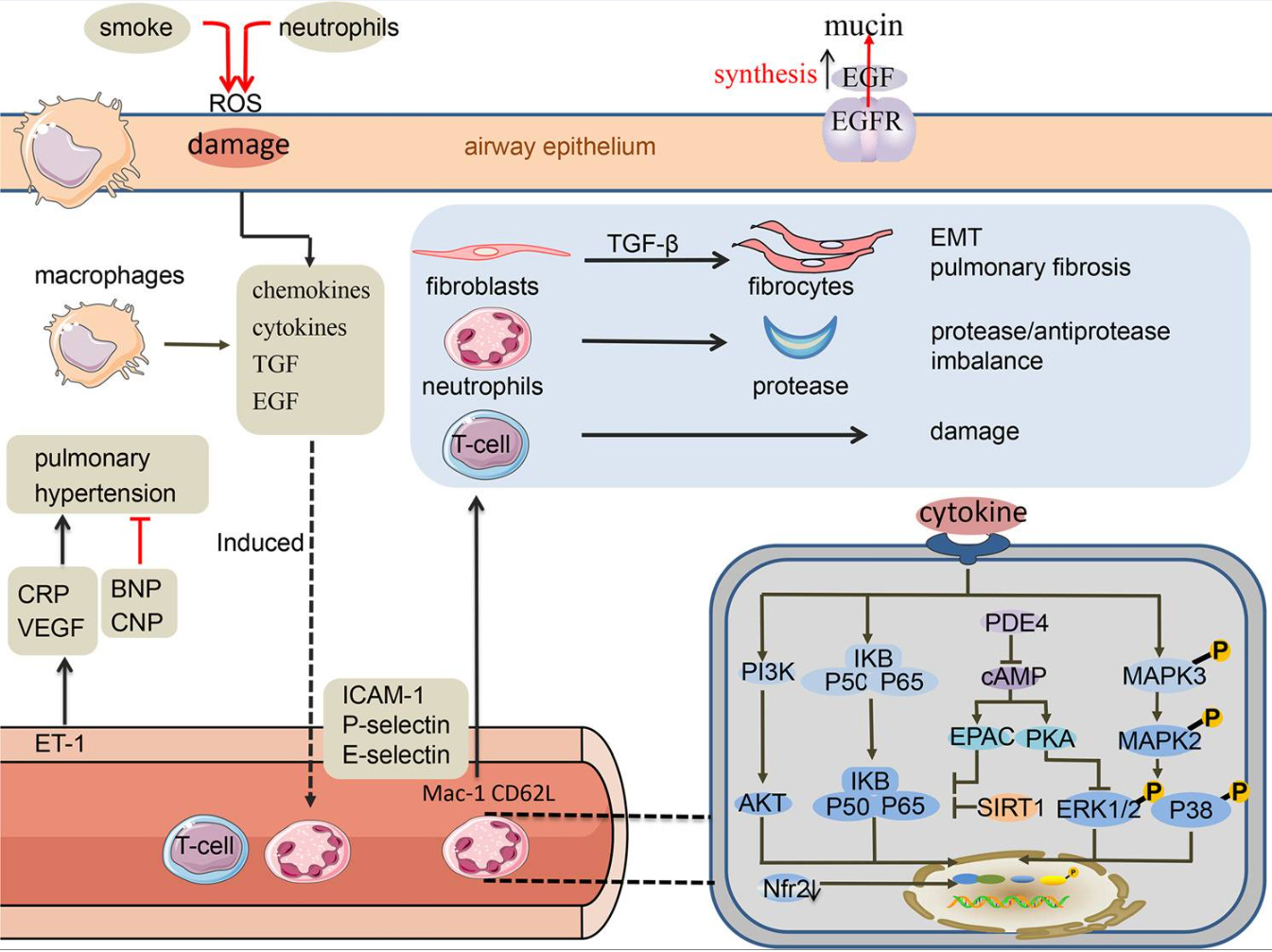
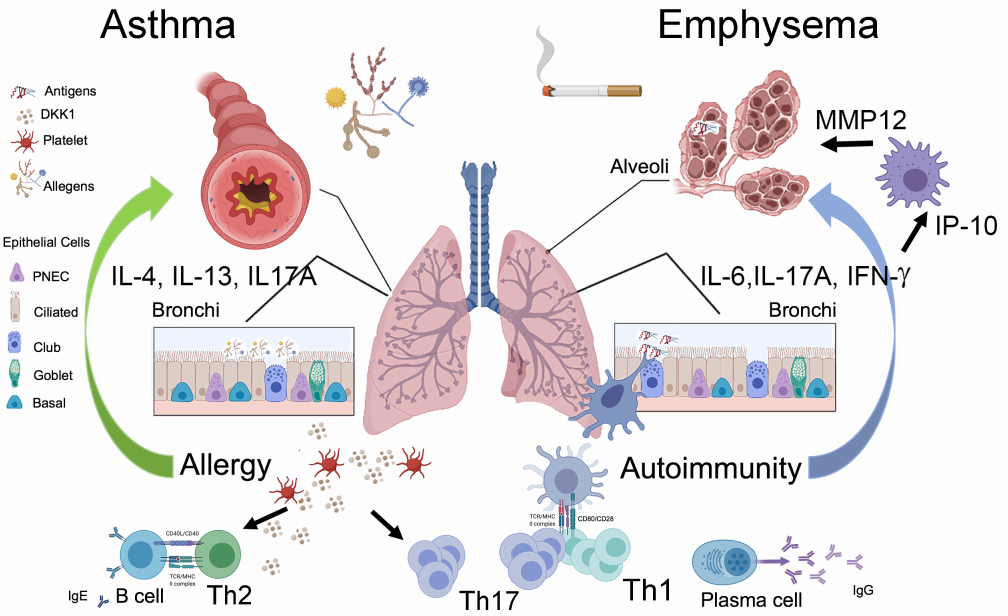
COPD的病理特征是气道重塑和中性粒细胞、CD8 T淋巴细胞和活化巨噬细胞的炎症细胞浸润。中性粒细胞在肺组织中的浸润程度与COPD的严重程度相关。在过去二十年中,对吸烟者肺组织的研究一直支持适应性免疫在病理生理学中的作用,例如气道和肺气肿变异型COPD,其在COPD和肺气肿发病机制中的重要性,首先是在针对人类肺组织的研究中提出的,随后在慢性烟雾暴露动物模型中进行了验证。
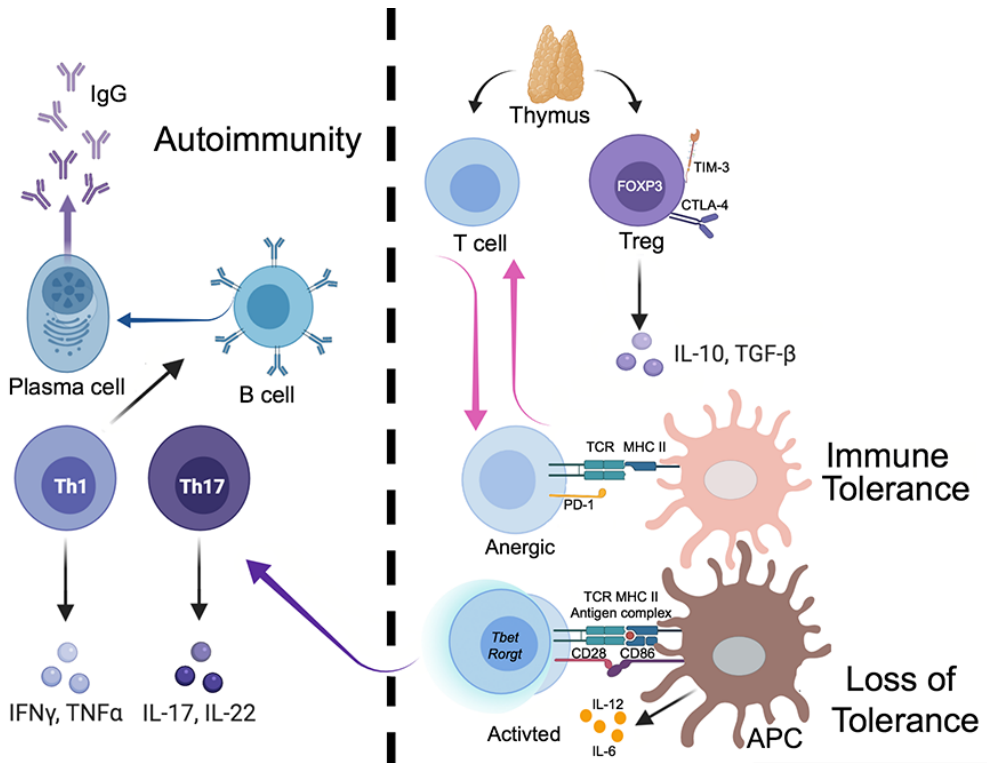
适应性免疫细胞如何对抗自身蛋白,一直是一个活跃的研究领域。在胸腺选择过程中,对自身蛋白反应强烈的T淋巴细胞被清除,而那些亲和力低的T淋巴细胞发展成为CD4+T细胞的一个特殊亚群,称为T调节细胞(Tregs),这些细胞表达典型转录因子Foxp3,并具有抑制T淋巴细胞活化的功能(图5)。
图5 外周免疫耐受丧失与自身反应性T淋巴细胞分化介导物(Kheradmand et al., 2022)。
依据CD4+T淋巴细胞分泌不同的细胞因子,可将其区分为Th1、Th2、Th17亚型,其中,Th2亚群已被证明在肺部过敏性炎症中起关键作用(图6)。Th1和Th17细胞及下游效应趋化因子可上调MMP12和MMP9,支持了诱导Th1和Th17适应性免疫应答烟雾暴露的作用,与肺气肿病理生理学相关(图6)。
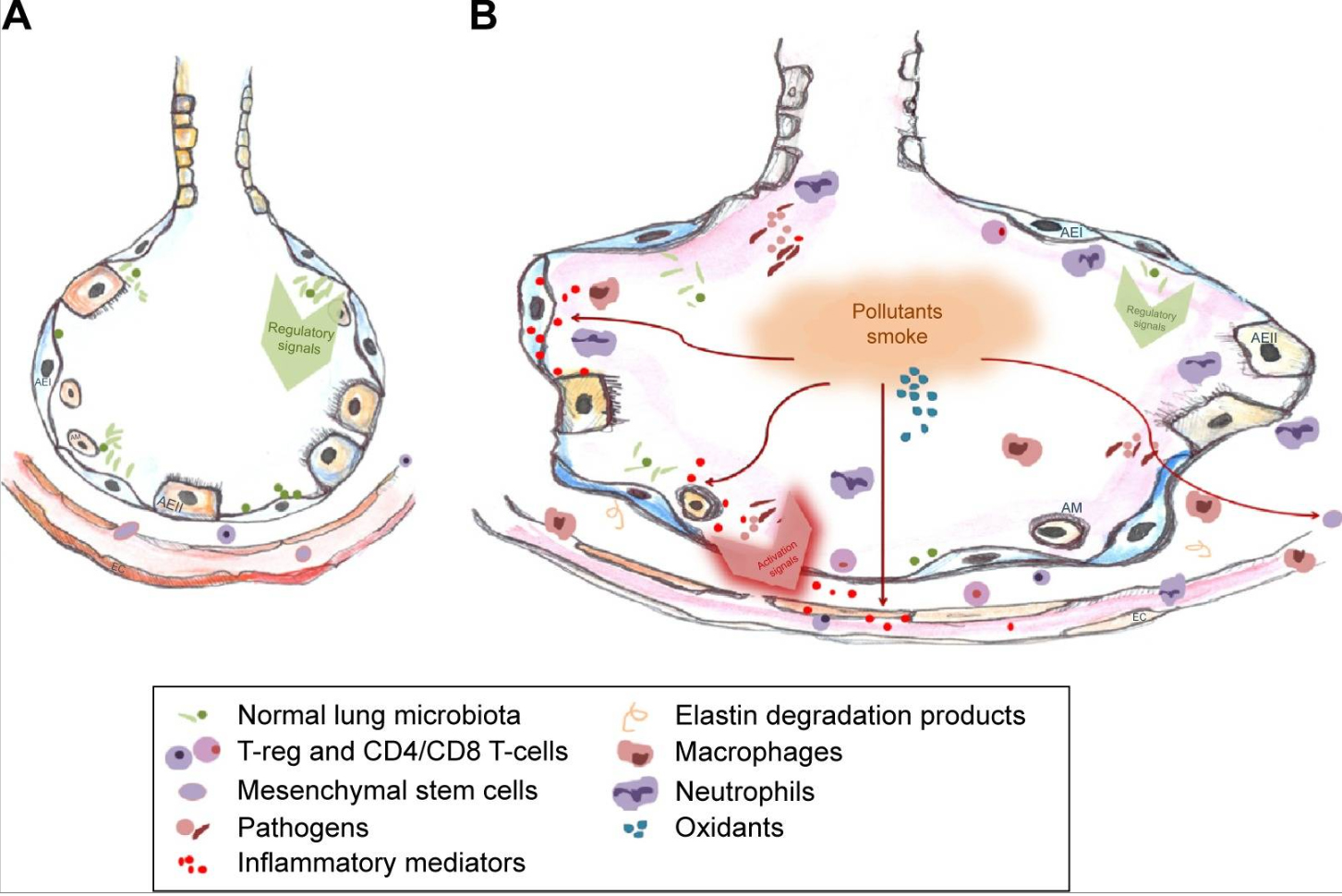
在淋巴结外和炎症条件下,B淋巴细胞可存在于肺中形成的三级淋巴聚集体中,其在吸烟者肺中的存在与COPD患者疾病严重程度分类呈正相关。并且,血清IgG浓度降低也与COPD急性加重有关。
针对患有或不患有COPD的吸烟者和对照组(从不吸烟者)分离的BAL细胞的分析显示,在COPD患者中,髓样细胞的主要亚群表达调节蛋白水平降低,这可能导致慢性炎症。并且患有COPD的活跃吸烟者与前吸烟者的肺泡巨噬细胞及组织巨噬细胞的丰度较高,表现出不同的表型,表明激活巨噬细胞具有促炎特征(Savage et al., 2020)。体外功能研究表明, COPD患者肺部Tfh细胞极化能力增强。
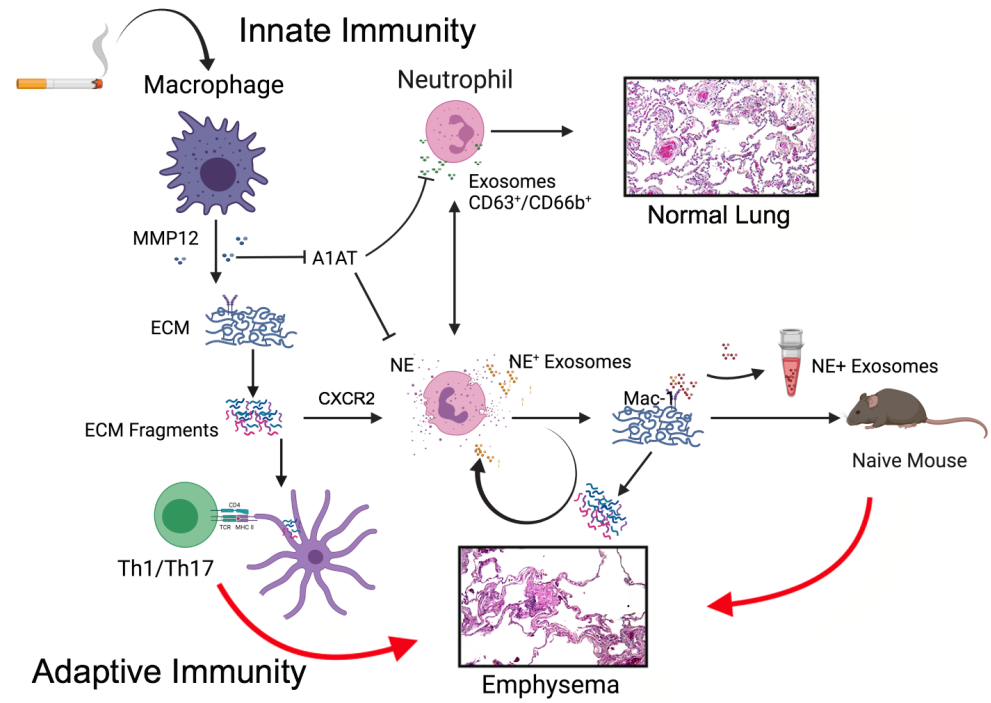
先天性免疫细胞源性蛋白酶可在COPD发病机制中降解ECM,促进肺结构细胞不稳定,单核细胞亚群在小鼠和人类之间是保守的,而巨噬细胞亚群则表现出物种特异性。iNOS是一种炎性巨噬细胞标志物,已被用于逆转COPD。
Caramori G, Casolari P, Barczyk A, Durham AL, Di Stefano A, Adcock I. COPD immunopathology. Semin Immunopathol. 2016;38(4):497-515.
Institute for Health Metrics and Evaluation (IHME). Findings from the Global Burden of Disease Study 2017. Seattle, WA: IHME, 2018.
Kheradmand F, Zhang Y, Corry DB. Contributions of acquired immunity to the development of COPD in humans and animal models. Physiol Rev. 2022;10.1152/physrev.00036.2021.
Rabe KF, Hurd S, Anzueto A, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med. 2007;176(6):532-555.
Savage PA, Klawon DEJ, Miller CH. Regulatory T Cell Development. Annu Rev Immunol. 2020;38:421-453.
Shao MX, Nakanaga T, Nadel JA. Cigarette smoke induces MUC5AC mucin overproduction via tumor necrosis factor-alpha-converting enzyme in human airway epithelial (NCI-H292) cells. Am J Physiol Lung Cell Mol Physiol. 2004;287(2):L420-L427.
Wang C, Zhou J, Wang J, et al. Progress in the mechanism and targeted drug therapy for COPD. Signal Transduct Target Ther. 2020;5(1):248.