近年来,随着对DNA修饰以及组蛋白修饰的了解越来越多,表观遗传学研究已受到了广泛关注。RNA修饰作为转录后基因调控的重要过程,已成为表观遗传学的热门话题。
表观遗传学分为三个层次的修饰和改变:转录、转录后和翻译后。表观遗传转录调控主要涉及DNA甲基化、组蛋白修饰和染色质重塑;转录后调控涉及RNA修饰和非编码RNA(ncRNA);翻译后修饰是蛋白质在翻译过程中或翻译后的共价修饰。
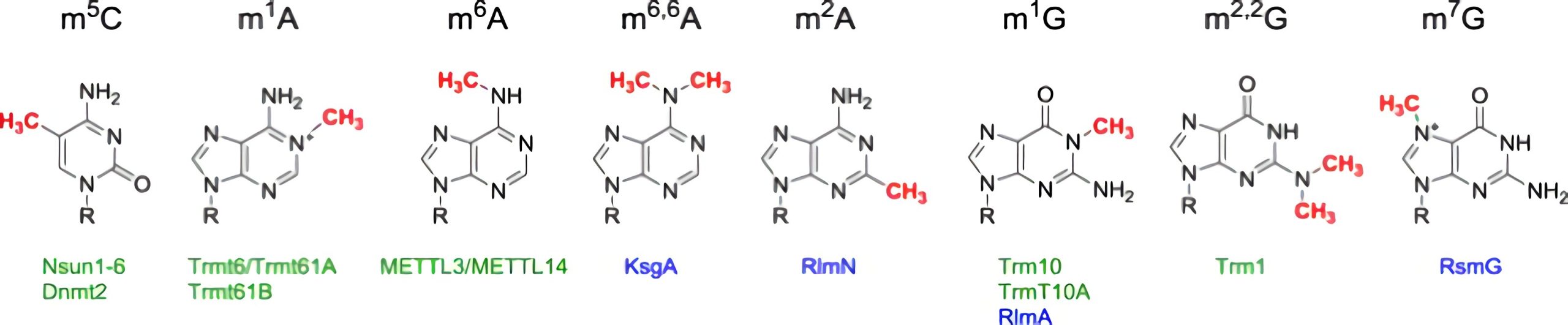
迄今为止,除典型四个RNA残基外,科学家们已在各种细胞RRNA中发现了约170多种RNA修饰,其中最常见和研究最充分的就是甲基化修饰(Boccaletto et al., 2018)。甲基化修饰占所有RNA化学修饰的60%以上,包括5-甲基胞嘧啶(m5C)、N1-甲基腺苷(m1A)、N6-甲基腺苷(m6A)、N7-甲基鸟苷(m7G)等(图1)。
本次,我们主要关注真核RNA甲基化修饰,下面就和伯小医一起来看看这些RNA甲基化修饰在细胞免疫中的作用吧!
1974年在大鼠信使mRNA中发现的RNA腺苷在氮6位的甲基化称为m6A(Desrosiers et al., 1974)。其作为最具特征和最普遍的mRNA修饰,在总腺苷残基中的出现概率为0.1-0.4%,介导mRNA代谢的各个方面,暗示与许多人类疾病相关。
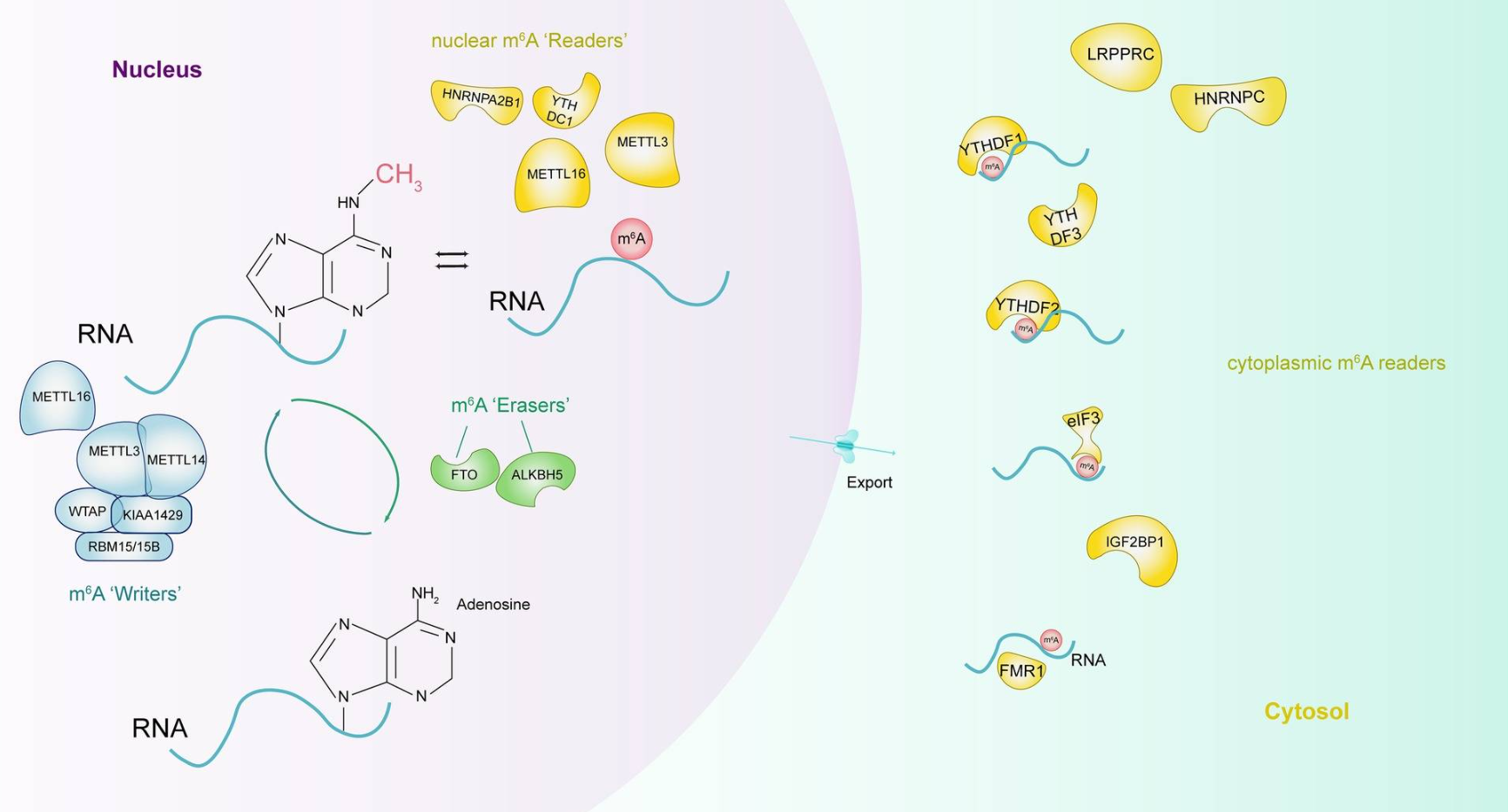

1.2 m6A与细胞免疫
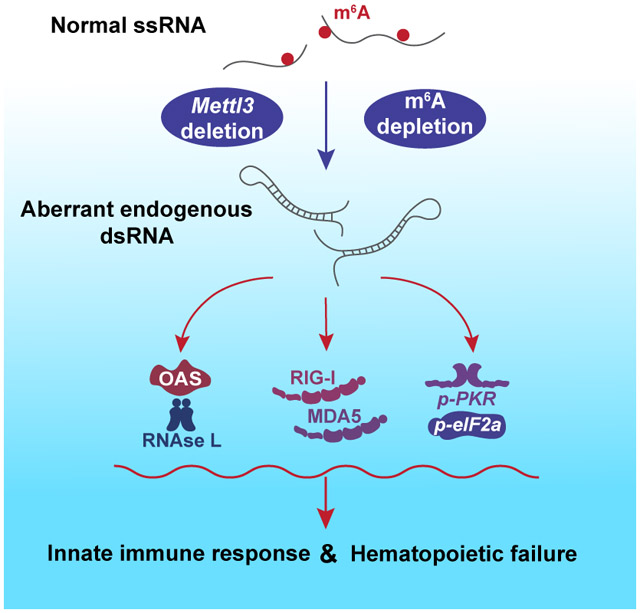
目前,已经证明RNA m6A修饰的存在维持了细胞对自体RNA的自我识别,而其缺失可导致造血干细胞和祖细胞(HSPCs)中异常内源性双链RNA(dsRNA)的形成,引发强烈的自然免疫反应和造血系统坏死(图4)。近年来,越来越多的证据表明,在人体免疫系统中,m6A在抗原识别和呈递以及先天性和适应性免疫中发挥重要作用。
图4 m6A修饰防止哺乳动物造血发育过程中的内源性dsRNA形成和有害的先天免疫反应机制示意图(Gao et al., 2020)。
1.2.1 T细胞中的m6A
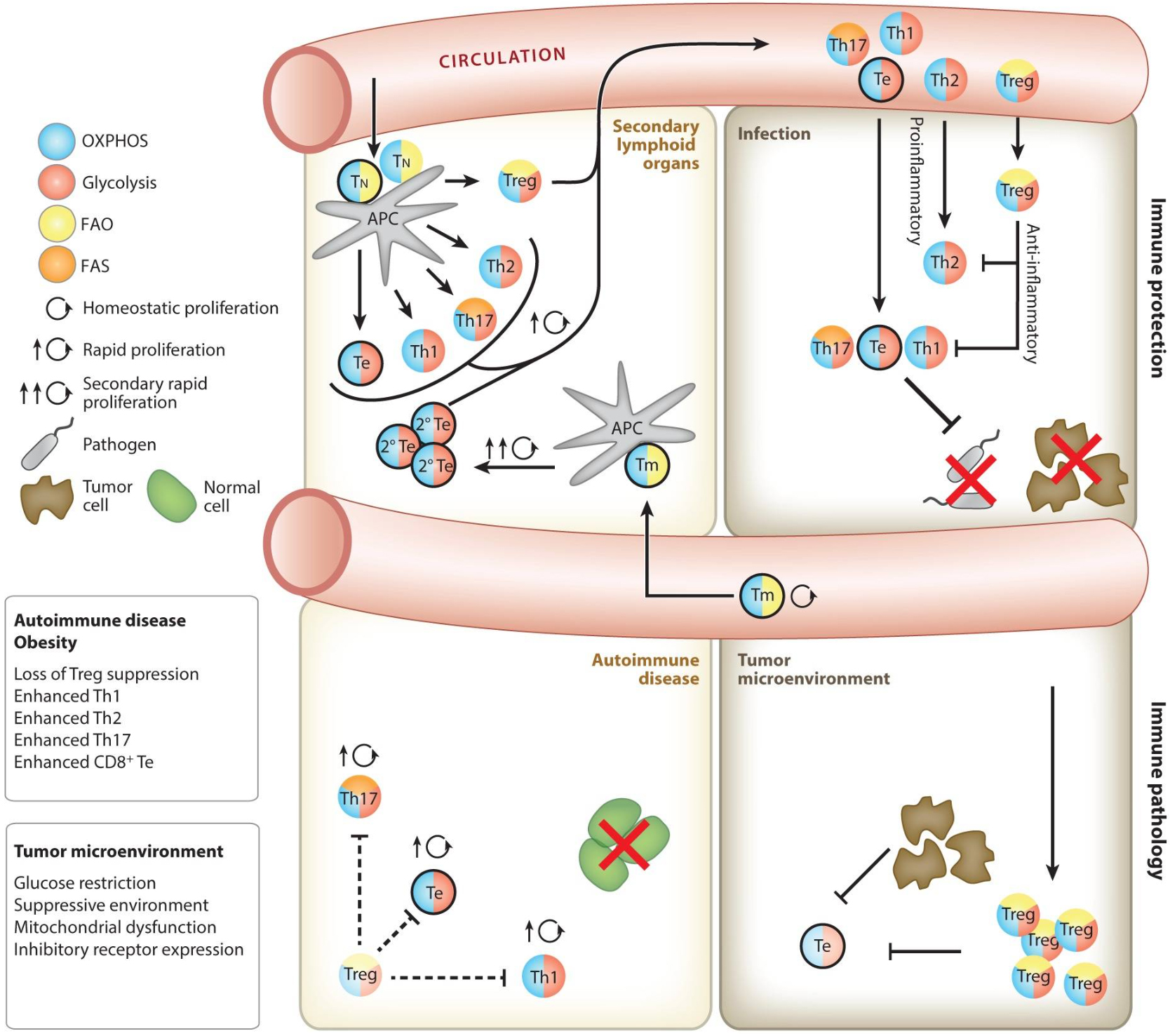
T淋巴细胞简称T细胞,由骨髓中的淋巴干细胞产生并在胸腺中成熟,根据其功能特性,分为三亚群:辅助性T(Th)细胞、细胞毒性T细胞和调节性T(Treg)细胞,亚群间相互控制并执行免疫任务,在免疫反应和不同生命阶段的作用在全身各不相同,其在免疫反应中的代谢如下图所示。
图5 免疫反应过程中的T细胞代谢(Geltink et al., 2018)。
CD4+T细胞主要起到Th细胞的作用,识别MHC II/外源性抗原肽,研究表明,m6A可调控未成熟CD4+T细胞的发育,但m6A修饰却对T细胞凋亡或TCR介导的增殖没有影响。
Tfh细胞是CD4+T细胞的一种特殊亚型,它在次级淋巴滤泡的形成、B细胞发育成浆细胞、抗体产生和Ig类别转换中发挥作用,m6A修饰也从事Tfh细胞的开发。
Treg细胞是一种抑制免疫系统的T细胞。m6A修饰还涉及Treg细胞的抑制功能。
1.2.2 B细胞中的m6A
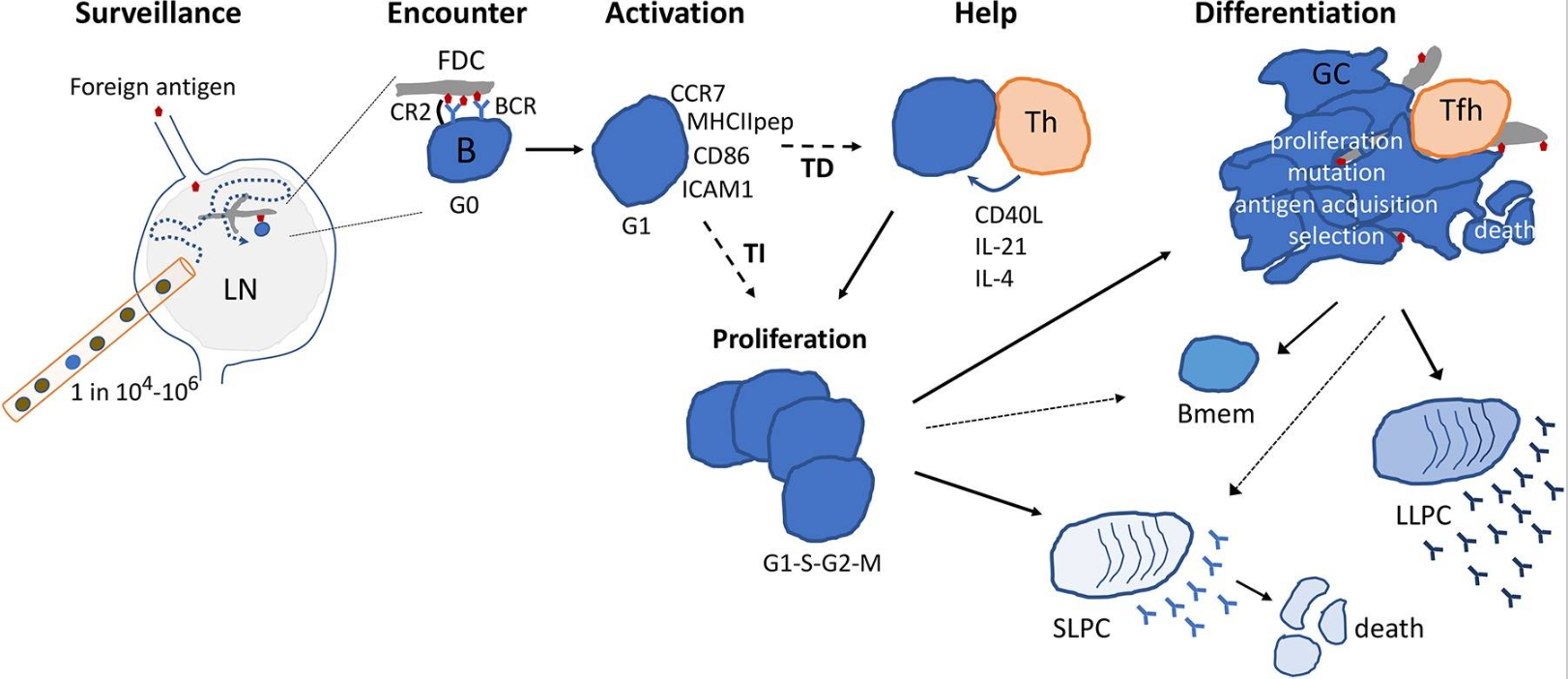
B细胞也来源于骨髓中的造血干细胞,响应抗原刺激而分化为浆细胞,合成和分泌免疫球蛋白(Ig),主要进行体液免疫。在B细胞发育的整个阶段,都会发生免疫球蛋白重链(IgH)和轻链基因的变化,以及细胞表面特异性分子的变化(图6)。
图6 B细胞反应的细胞动力学(Cyster et al., 2019)。
最近,已经证明m6A修饰在早期B细胞发育过程中起着关键的调节作用,如“写入器”WTAP与“阅读器”YTHDF2是CD40的关键抑制器,CD40在B细胞发育、活化、GC形成和类别转换抗体中具有重要作用;并且,m6A修饰控制早期B细胞发育和IL-7诱导的前B细胞增殖,m6A修饰的损害阻碍了B细胞增殖、发育和成熟(Zhao et al., 2022)。
1.2.3 树突状细胞中的m6A
树突状细胞(DC)充当先天免疫反应和适应性免疫反应之间的联系,是人体最强大的特化抗原呈递细胞(APC),在抗原摄取、加工和呈递方面非常高效。小鼠和人类的DC可进一步分为两个主要谱系,其特征在于转录因子依赖性、标记表达和功能(图7),未成熟的DC具有强大迁移能力,成熟DC可有效激活初始T细胞,这些T细胞对于免疫反应的启动、调节和维持至关重要。
与未成熟DC相比,成熟DC中的大量基因在免疫反应和炎症反应中表现出独特的m6A改变。研究表明,m6A修饰可通过改变mRNA翻译效率激活DC功能,其还与DC向淋巴结的迁移有关,以及对于DC从未成熟细胞发育为强T细胞激活剂至关重要。
1.2.4 其他免疫细胞中的m6A
巨噬细胞可吞噬和破坏细胞内寄生虫、细菌、肿瘤细胞以及它们自身的衰老和死亡细胞,同时还可执行免疫防御、免疫自我稳定和免疫监视任务,具有极强的延展性,并且会根据体内不同的组织环境而在形态和功能上发生变化,响应各种刺激而极化为M1和M2亚型。m6A对巨噬细胞的作用主要包括抗病毒免疫、负反馈激活和巨噬细胞极化调制。
自然杀伤细胞(NK)是主要的天然免疫淋巴细胞,对人体的免疫系统有重要贡献,不仅在对抗肿瘤、病毒感染和免疫调节方面,而且在某些情况下也有助于超敏反应和自身免疫性疾病的发展。m6A可影响NK介导的针对细菌和癌症的免疫反应。
m5C是所有生命领域RNA中一个保守且普遍的标记,长期以来一直被视为DNA的表观遗传修饰。近年来研究发现,其广泛存在于RNA中,真核tRNA和rRNA中含量最多。m5C对RNA的修饰是由两种m5C甲基转移酶编写的:一种是DNMT2,另一种是Nol1/Nop2/Sun(NSUN)家族蛋白的成员,包括NSUN1到NSUN7。
2.2 m1A调控机制
1960年代,科学家们在一小群微生物的DNA和大量生物体的RNA中发现了m1A修饰,虽在tRNA和rRNA中占主导地位,但也存在于mRNA中,但比含m6A修饰的mRNA少10倍。在tRNA和rRNA中,m1A保留三级结构并影响翻译,在mRNA中,其主要存在于高度结构化的5’UTR区,特别是在转录起始位点的第一个和第二个位置。因此,m1A甲基化原子的位置决定了这种修饰的功能和机制(Shi et al., 2020)。
2.3 m7G调控机制
除其他RNA甲基化外,m7G修饰是tRNA、18S rRNA和mRNA cap中最普遍的RNA修饰之一,其常见于真细菌、真核生物和一些古细菌中,是少数将带正电荷或两亲离子引入核碱基的甲基化修饰之一。m7G对mRNA、tRNA和rRNA具有广泛的影响,在包括转录延伸、前mRNA剪接和mRNA翻译在内的各种生物学过程中发挥着至关重要的作用,也是疾病诊断的重要指标。
Chen XY, Zhang J, Zhu JS. The role of m6A RNA methylation in human cancer. Mol Cancer. 2019;18(1):103.
Cyster JG, Allen CDC. B Cell Responses: Cell Interaction Dynamics and Decisions. Cell. 2019;177(3):524-540.
Desrosiers R, Friderici K, Rottman F. Identification of methylated nucleosides in messenger RNA from Novikoff hepatoma cells. Proc Natl Acad Sci U S A. 1974;71(10):3971-3975.
Gao Y, Vasic R, Song Y, et al. m6A Modification Prevents Formation of Endogenous Double-Stranded RNAs and Deleterious Innate Immune Responses during Hematopoietic Development. Immunity. 2020;52(6):1007-1021.e8.
Gardner A, Ruffell B. Dendritic Cells and Cancer Immunity. Trends Immunol. 2016;37(12):855-865.
Geltink RIK, Kyle RL, Pearce EL. Unraveling the Complex Interplay Between T Cell Metabolism and Function. Annu Rev Immunol. 2018;36:461-488.
Shi H, Chai P, Jia R, et al. Novel insight into the regulatory roles of diverse RNA modifications: Re-defining the bridge between transcription and translation. Mol Cancer. 2020;19(1):78.
Song P, Tayier S, Cai Z, Jia G. RNA methylation in mammalian development and cancer. Cell Biol Toxicol. 2021;37(6):811-831.
Stojković V, Fujimori DG. Mutations in RNA methylating enzymes in disease. Curr Opin Chem Biol. 2017;41:20-27.
Zha LF, Wang JL, Cheng X. The effects of RNA methylation on immune cells development and function. FASEB J. 2022;36(10):e22552.
Zhao C, Xu G, Zhang X, et al. RNA m6A modification orchestrates the rhythm of immune cell development from hematopoietic stem cells to T and B cells. Front Immunol. 2022;13:839291.