众所周知,高血压是心血管疾病最主要危险因素[1]。
维持正常的人体血压值,对降低心血管疾病的发生率和死亡率有重要意义,而血压调节离不开人体中盐和体液的健康平衡。
世界卫生组织推荐的每天最多盐摄入量为5克,但是事实上全球平均每天的盐摄入量为8-10克[2]。
此前的研究表明,减少饮食中钠离子(Na+)的摄入能够显著降低高血压及其相关疾病的发生。因此,对于心血管疾病危险人群,医生一般会建议清淡(低盐、低脂)饮食,尤其是盐敏感性血压(SSBP)人群。
那么“吃咸了”是如何影响血压的呢?机体中的免疫细胞在这一生理过程中扮演什么角色呢?
近期,范德堡大学的Annet Kirabo和她的研究团队,在心血管疾病领域著名期刊Circulation Research发表重要研究成果,揭示了过多盐摄入通过激活NLRP3炎症小体,导致血压升高的潜在机制[3]。
他们发现,高浓度盐处理能促进抗原呈递细胞中NLRP3炎症小体激活,而这种激活依赖于上皮钠通道(ENaC)和IsoLG-加合物的形成。NLRP3基因缺失能够减弱高盐饮食诱导血压升高的效应,移植正常表达NLRP3的抗原呈递细胞,又能够重建高盐诱导高血压的效应。
这项研究不仅揭示了NLRP3激活参与盐敏感性高血压的新机制,还为盐敏感性血压人群的诊断提供了新的潜在生物标志物。
论文首页截图
盐敏感性血压是一种血压对盐负荷和盐消耗变化过度反应生理现象,在普通人群中出现的概率为25%,而在高血压人群中出现这一现象的概率为50%。
此前,已经有证据表明高盐饮食会诱发自身免疫和炎症反应,但是其中的生理机制尚不清楚。固有免疫和适应性免疫在盐敏感性高血压发生的病理机制中发挥重要作用,多项研究表明,高NaCl浓度能够诱导小鼠的巨噬细胞和T细胞呈现促炎状态。
Annet Kirabo团队此前的研究发现,过量的细胞外钠能够促进树突细胞中IL-1β的生成,进而刺激T细胞产生IL-17A来介导盐敏感性高血压。
IL-1β水平在高血压患者血浆中升高,炎症小体,尤其是NLRP3炎症小体是循环中IL-1β的主要来源。然而,抗原呈递细胞的炎症小体激活是否在盐敏感性高血压的发病中起作用尚不清楚。
在本研究中,Kirabo团队假设钠依赖于ENaC进入抗原呈递细胞,通过IsoLG的形成激活NLRP3炎症小体,导致盐敏感性高血压。
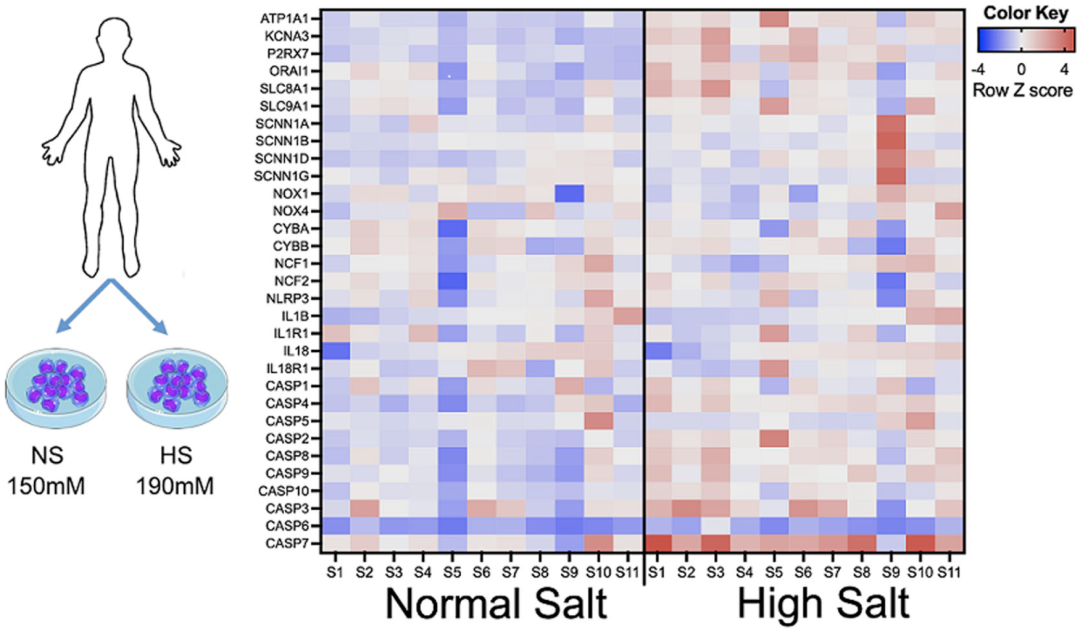
前文已经提到,高NaCl浓度能够诱导小鼠的巨噬细胞和T细胞呈现促炎状态,那么对人单核细胞进行高盐处理后,细胞的转录表达谱会发生那些变化呢?
为了解答这一问题,Kirabo和她的同事收集了11名血压正常成年人的单核细胞,在体外给予不同盐浓度(150 mMol/L 或190 mMol/L)处理72小时后,进行RNA测序。
他们对钠转运、NOX和NLRP3炎症小体相关基因的表达进行分析,结果发现:在高盐条件下,NOX2以及转运和通道相关的基因表达增加。此外,NLRP3炎症小体激活相关基因(如IL-1β,IL-18,IL18R1,CASP1,CASP2,CASP7等)在高盐处理组的单核细胞中表达水平升高。
RNA测序数据显示高钠浓度对人类单核细胞的影响
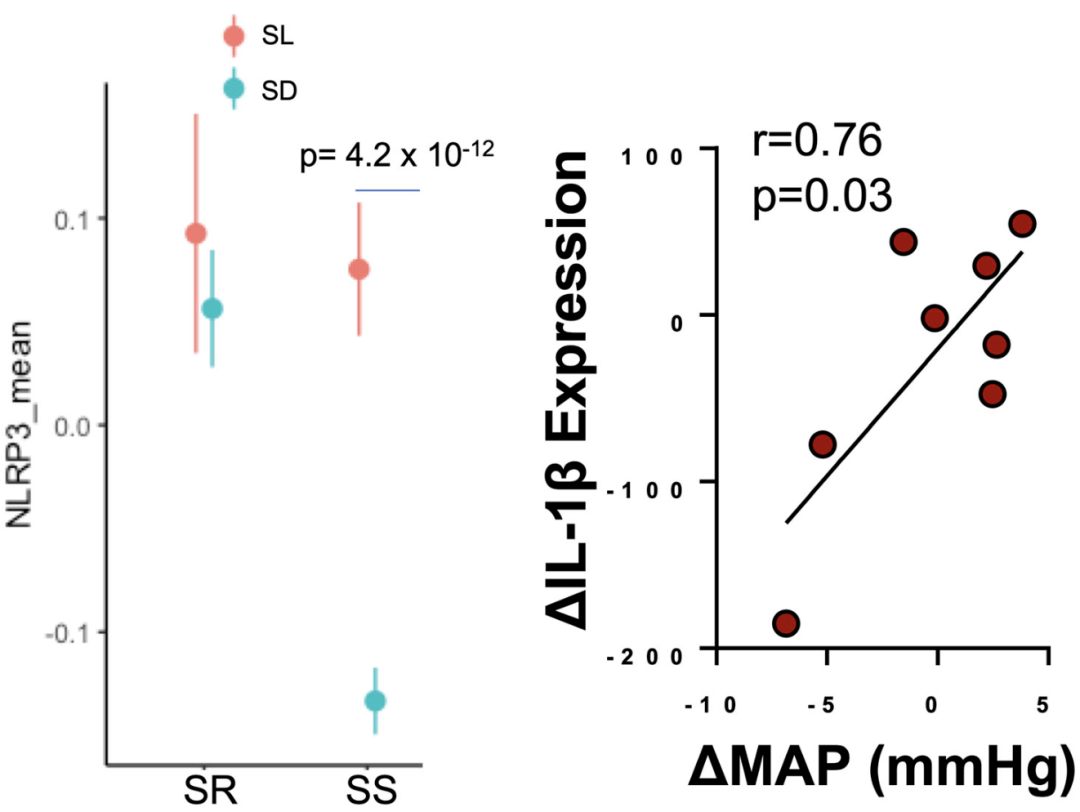
为了证实炎症小体在盐敏感性血压人群单核细胞中的表达变化是否与血压的变化相一致,Kirabo团队监测了10名SSBP患者在高盐饮食前后的血压数值,并同时收集了患者的外周血单个核细胞用于Cite-Seq分析。
研究结果发现,单核细胞中NLRP3炎症小体表达水平的变化,能够反映高盐饮食摄入后血压的变化,同时血压的变化与IL-1β水平的变化相一致。
这些结果表明,炎症小体和单核细胞的激活受到饮食中钠含量的动态调节,而且它们可能是潜在的盐敏感性血压诊断标志物。
NLRP3炎症小体和激活标志物IL-1β的成分随着盐负载/消耗的变化而动态变化
我们都知道,细胞中的IL-1β有不同的生成机制。
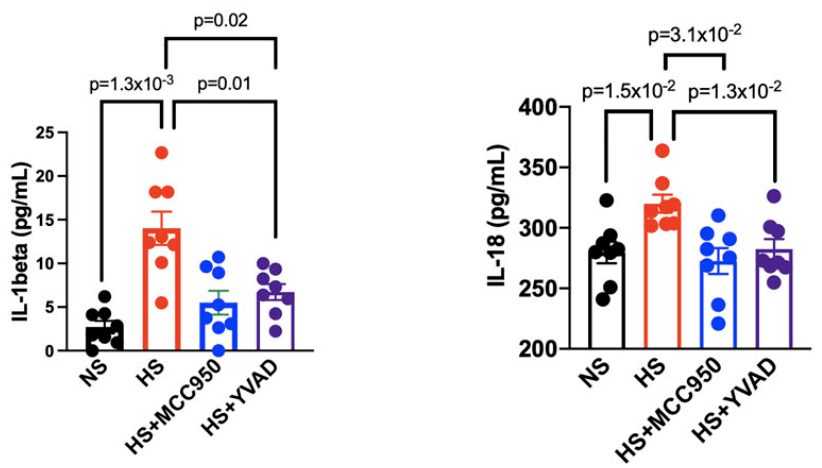
此前有研究表明,高血压能够刺激小鼠树突细胞中IL-1β和IsoLGs的生成。为了探究在高盐条件下炎症小体激活诱导炎症反应的机制,研究人员在脾细胞培养液中加入NLRP3炎症小体的抑制剂(MCC950,1 µM)或caspase-1的抑制剂(Ac-YVAD-cmk,5 ug/mL),并检测不同实验组中IL-1β+的白细胞、树突细胞和单核细胞占比,以及IL-1β的表达水平。
研究结果表明,IL-1β的表达依赖于NLRP3的激活。此外,给高盐饮食喂养的小鼠腹腔注射MCC950后发现,IL-1β的分泌、IsoLG蛋白加合物的形成以及NLRP3的表达都显著减少。
为了探究ENaC在炎症小体激活中的作用,小鼠脾细胞在进行高盐处理之前先用ENaC抑制剂进行孵育,流式细胞分析结果表明,在抗原呈递细胞中抑制ENaC能明显减少细胞中NLRP3,IL-1β的表达以及IsoLG蛋白加合物的形成。
IL-1β、IL-18的表达依赖于NLRP3的激活
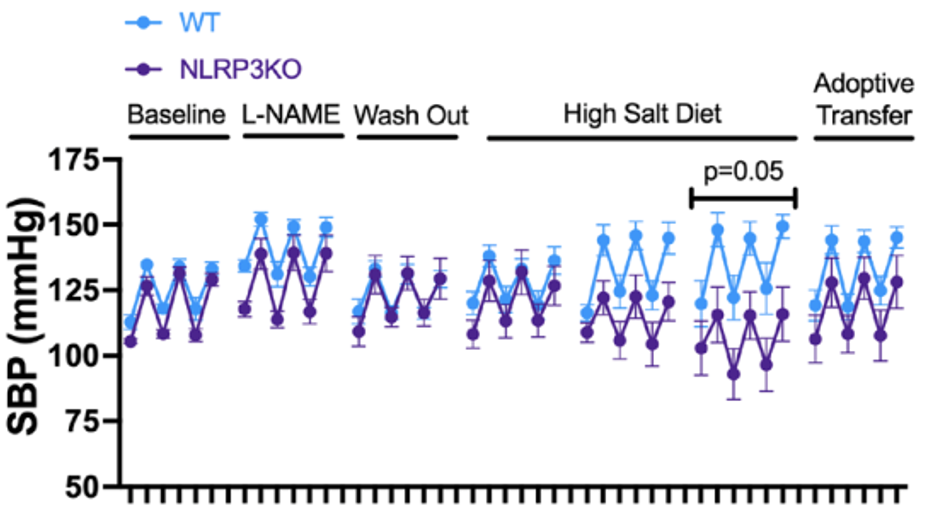
进一步的,Kirabo团队通过给予NLRP3基因敲除小鼠高盐饮食,来探究NLRP3的表达是否足以诱导高盐条件下血压升高。
动物实验的结果表明,NLRP3基因缺失后并不影响基础血压值,但是高盐诱导的血压升高效应受到显著抑制。接着,他们将野生型小鼠的树突状细胞移植到NLRP3缺陷小鼠的盐敏感小鼠模型,发现这种高盐诱导的血压升高效应得以恢复。
NLRP3基因缺失以及NLRP3抗原呈递细胞特异性回补对于收缩压的影响
总的来说,这个研究揭示了抗原呈递细胞中依赖ENaC的NLRP3炎症小体激活,进一步阐明了盐敏感性高血压发生的病理机制。
盐敏感性高血压与心血管预后差之间的密切关系表明,盐敏感性是降低心血管死亡率的主要目标。然而,膳食盐导致高血压、器官损伤和不良心血管预后的确切机制仍有待阐明。
这些研究结果揭示了内皮钠通道,炎症以及盐敏感性高血压之间相关联的潜在机制,而且他们之间的关联与抗原呈递细胞中NLRP3炎症小体激活有关,这一发现可能成为治疗盐敏感性高血压的潜在靶点。
参考文献:
[1]. Lim SS, Vos T, Flaxman AD, et al. A comparative risk assessment of burden of disease and injury attributable to 67 risk factors and risk factor clusters in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010 [published correction appears in Lancet. 2013 Apr 13;381(9874):1276] [published correction appears in Lancet. 2013 Feb 23;381(9867):628. AlMazroa, Mohammad A [added]; Memish, Ziad A [added]]. Lancet. 2012;380(9859):2224-2260. doi:10.1016/S0140-6736(12)61766-8
[2]. Rust P, Ekmekcioglu C. Impact of Salt Intake on the Pathogenesis and Treatment of Hypertension. Adv Exp Med Biol. 2017;956:61-84. doi:10.1007/5584_2016_147
[3]. Pitzer A, Elijovich F, Laffer CL, et al. DC ENaC-Dependent Inflammasome Activation Contributes to Salt-Sensitive Hypertension. Circ Res. 2022;131(4):328-344. doi:10.1161/CIRCRESAHA.122.320818
文章来源:奇点网