将外源基因导入细胞,并使其在细胞中表达的方式可分为两大类:
(1)瞬时表达(transient gene expression,TGE),即外源DNA/RNA不会整合到宿主染色体中,虽可达到高水平表达,但通常只持续几天,一般会在96h内失效;
(2)稳定表达(Stable gene expression,SGE),即外源DNA会整合到宿主细胞染色体上,使宿主细胞可长期表达目的基因。
稳定细胞株适用于各种研究应用,如重组蛋白和抗体生产、基因编辑、功能性研究等等。
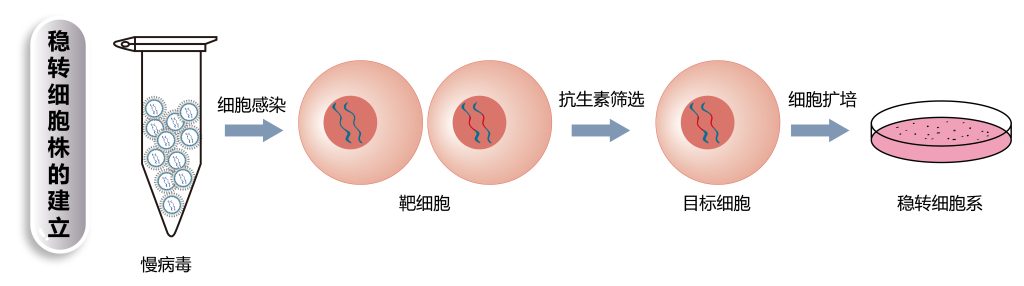
传统质粒载体受制于质粒大小、转染介质的限制,对很多细胞转染效率低,而且质粒整合入细胞基因组的效率极低,所以构建稳转株的成功率不高。由于慢病毒几乎可以感染所有种类的细胞,并且在感染后容易整合到受感染细胞的基因组,进行长时间稳定表达,因此,目前,医学研究领域已广泛采用“慢病毒感染——药物筛选法”进行稳转细胞株的构建,其已成为构建稳转细胞株最主流的方法。
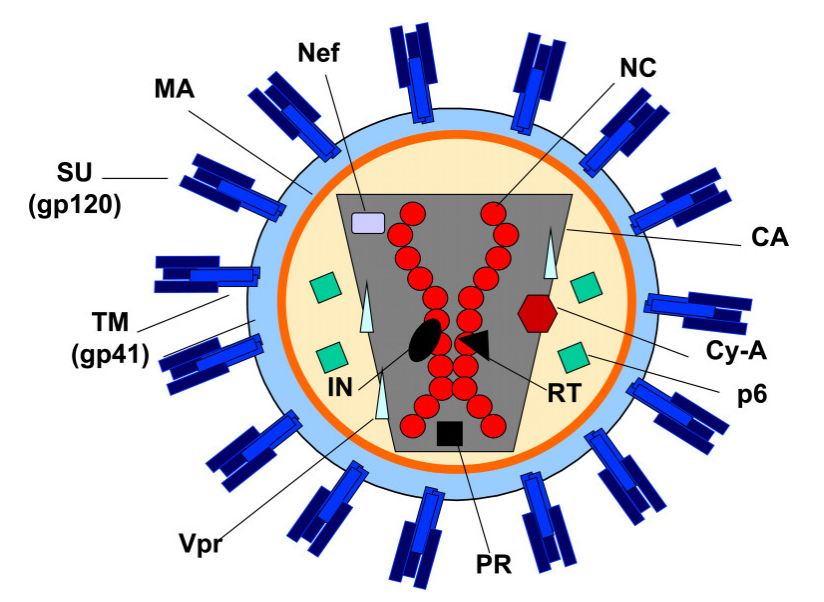
慢病毒(Lentivirus,LV)属反转录病毒科(Retrovirus),是球形包膜病毒,直径约80-120nm,含两个拷贝的单链RNA基因组(图2)。基因组包含在由结构和酶促蛋白核衣壳(NC)、衣壳(CA)、逆转录酶(RT)、整合酶(IN)和蛋白酶(PR)组成的核心内,核心被基质(MA)蛋白的蛋白质层包围(图2)。包膜蛋白(ENV)嵌入病毒粒子脂质包膜中,它与靶细胞受体结合并介导病毒粒子进入。
图2 慢病毒结构(Dufait et al., 2013)。
2)慢病毒载体
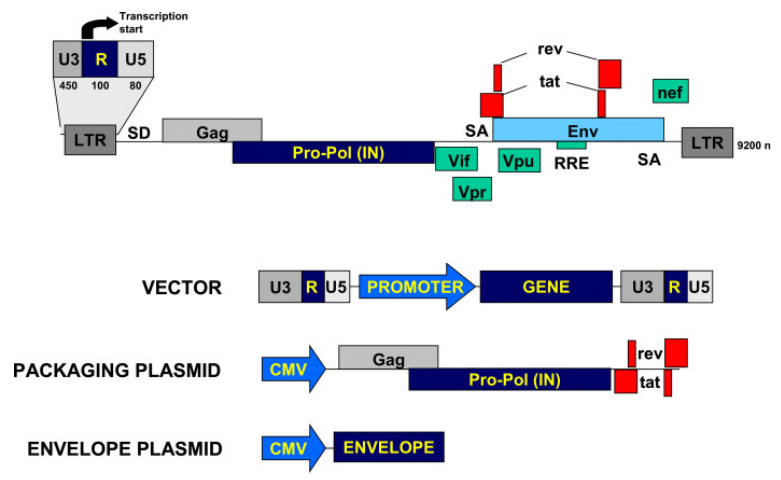
最经典的慢病毒载体(Lentivectors)是以人类免疫缺陷型病毒(HIV)为基础发展起来的基因治疗载体,且HIV-1/HIV-2系统已得到了广泛应用。目前,慢病毒载体通常是在293T细胞中进行三质粒共转染后获得的,其中三质粒系统为:
(1)包装质粒:提供结构和RT蛋白(Gag-Pol),我司采用pMD2.G质粒载体。
(2)包膜质粒:编码一种糖蛋白来假型化载体颗粒,该过程包括在病毒脂质包膜中掺入异源Env。最常用的Env之一是水疱性口炎病毒糖蛋白(VSV-G),其赋予载体稳定性以及广泛的细胞趋向性。我司采用psPAX2质粒载体。
(3)转移质粒:包含用于复制/转录和包装的顺式作用序列。其中包含的启动子可促使任何感兴趣的基因均以细胞类型特异性或非特异性方式表达。我司采用pLV系列质粒载体。
图3 HIV-1基因组结构与慢病毒载体包装质粒系统(Dufait et al., 2013)。
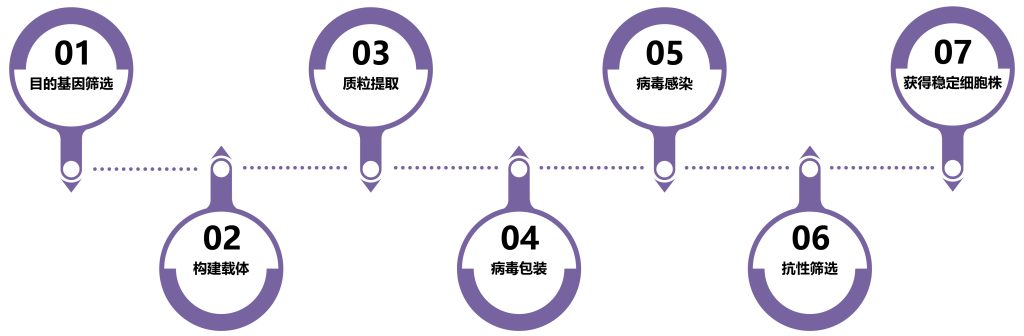
3)慢病毒包装流程
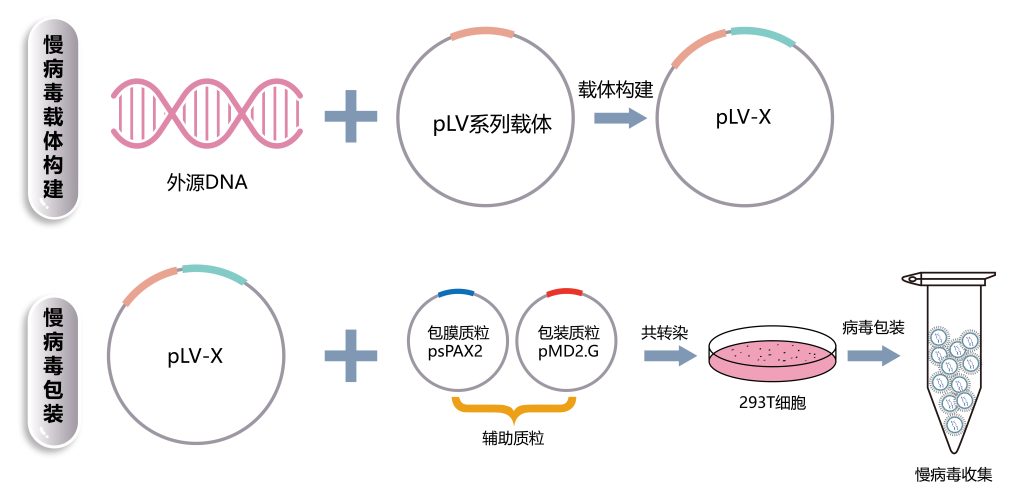
① 构建目的基因真核表达载体,我司包含过表达、干扰沉默、基因敲除等系列载体,可依据不同需求,选择不同载体;
② 制备包装质粒:以去内毒素质粒抽提试剂盒提取慢病毒包装系统中三种质粒(常见pLV、psPAX2、pMD2.G);
③ 目的基因质粒载体与其他包装质粒共转染293T细胞,293T细胞株为慢病毒的包装细胞;
④ 收集病毒上清液:细胞转染后收集细胞培养上清液并过滤即可;
⑤ 病毒浓缩与纯化:为高效感染目的细胞,需将收集好的病毒上清液进行浓缩和纯化,以此提高病毒的滴度和纯度,便于下游试验的开展。
注:我司采用超速离心沉淀法或PEG8000浓缩法进行慢病毒的浓缩纯化。
⑥ 病毒滴度测定与质控:常见荧光计数法、定量PCR法检测整合到基因组DNA中的病毒序列、p24蛋白ELISA试剂盒检测法、qRT-PCR试剂盒检测法检测病毒样本中的基因组拷贝数。
4)慢病毒优势与特点
① 感染效率高:与传统质粒转染相比,慢病毒感染无需转染试剂,且感染效率高。
② 感染谱更广:慢病毒可高效感染神经细胞、肝细胞、心肌细胞、内皮细胞、干细胞、原代细胞等多种通常不容易转染的细胞。
③ 稳定表达:相比瞬时转染,慢病毒载体可以将外源基因有效地整合到宿主染色体上,并可稳定持续表达。
构建稳转细胞株的基本原理就是将外源DNA克隆到具有某种抗性(常见嘌呤霉素(Puromycin,Puro)、新霉素(Neomycin,Neo)或G418)的载体上,再将载体通过不同的转染方式转染宿主细胞,使其整合到宿主染色体中,最后采用载体抗性进行筛选,得到可稳定过表达或沉默或敲除或编辑特定基因的细胞株。经标准药筛后,我司可提供多克隆细胞群或单克隆细胞株。
2)我司细胞株类型
① 过表达基因的稳转细胞株(可选单克隆、多克隆细胞株,以及细胞传代代数);
② shRNA基因干扰的稳转细胞株(可选单克隆、多克隆细胞株,以及细胞传代代数);
③基于CRISPR/Csa9系统随机敲除的稳转细胞株(可选单克隆、多克隆细胞株,以及细胞传代代数);
3)稳转细胞株构建方法
① 确定最适慢病毒感染复数(multiplicity of infection,MOI),即感染时病毒与细胞数量的比值;
注:为了达到最佳的实验效果,建议在正式实验前进行3-4种不同MOI值感染预实验。
② 确定目的细胞药物筛选浓度。不同细胞对同种抗生素,其筛选浓度不同;同种细胞对不同抗生素,其最佳使用浓度也不同。
③ 慢病毒感染目的细胞。
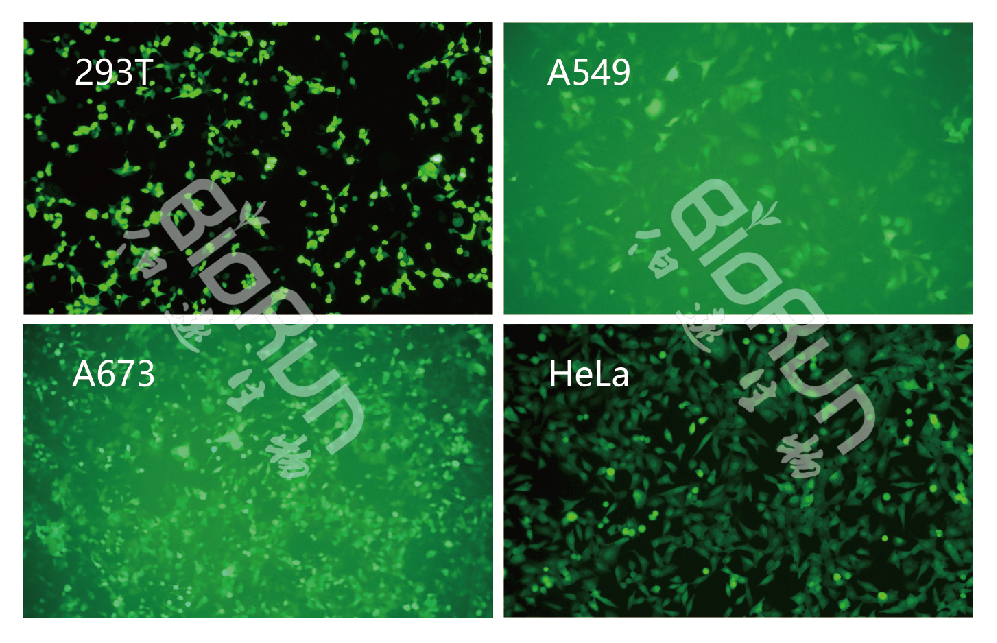
图5 我司慢病毒感染细胞效率实例。
④ 抗生素筛选稳转株。
注:一般在感染24h后才开始进行抗生素筛选,抗生素表达阳性细胞死亡后需及时换液。
⑤ 稳转细胞株的检测,包括mRNA水平检测(我司采用qRT-PCR法)以及蛋白水平检测(我司采用Western blot或细胞免疫荧光技术)。
⑥ 检测合格后,对细胞系进行扩大培养与冻存。
以上步骤即为构建多克隆稳转细胞系流程,若需构建单克隆稳转细胞株,则还需进行以下步骤:
① 对筛选后的多克隆稳转细胞株进行稀释培养,常见方法为有限稀释法以及流式分选,我司采用有限稀释法。
② 单细胞经细胞扩增后,继续采取抗生素进行第二轮筛选;
③ 筛选完成后,收集细胞进行mRNA水平及蛋白水平检测,选择结果正常的单克隆细胞冻存保种。
Tandon N, Thakkar KN, LaGory EL, et al. Generation of Stable Expression Mammalian Cell Lines Using Lentivirus. Bio Protoc. 2018;8(21):e3073.
Xu K, Ma H, McCown TJ, et al. Generation of a stable cell line producing high-titer self-inactivating lentiviral vectors. Mol Ther. 2001;3(1):97-104.