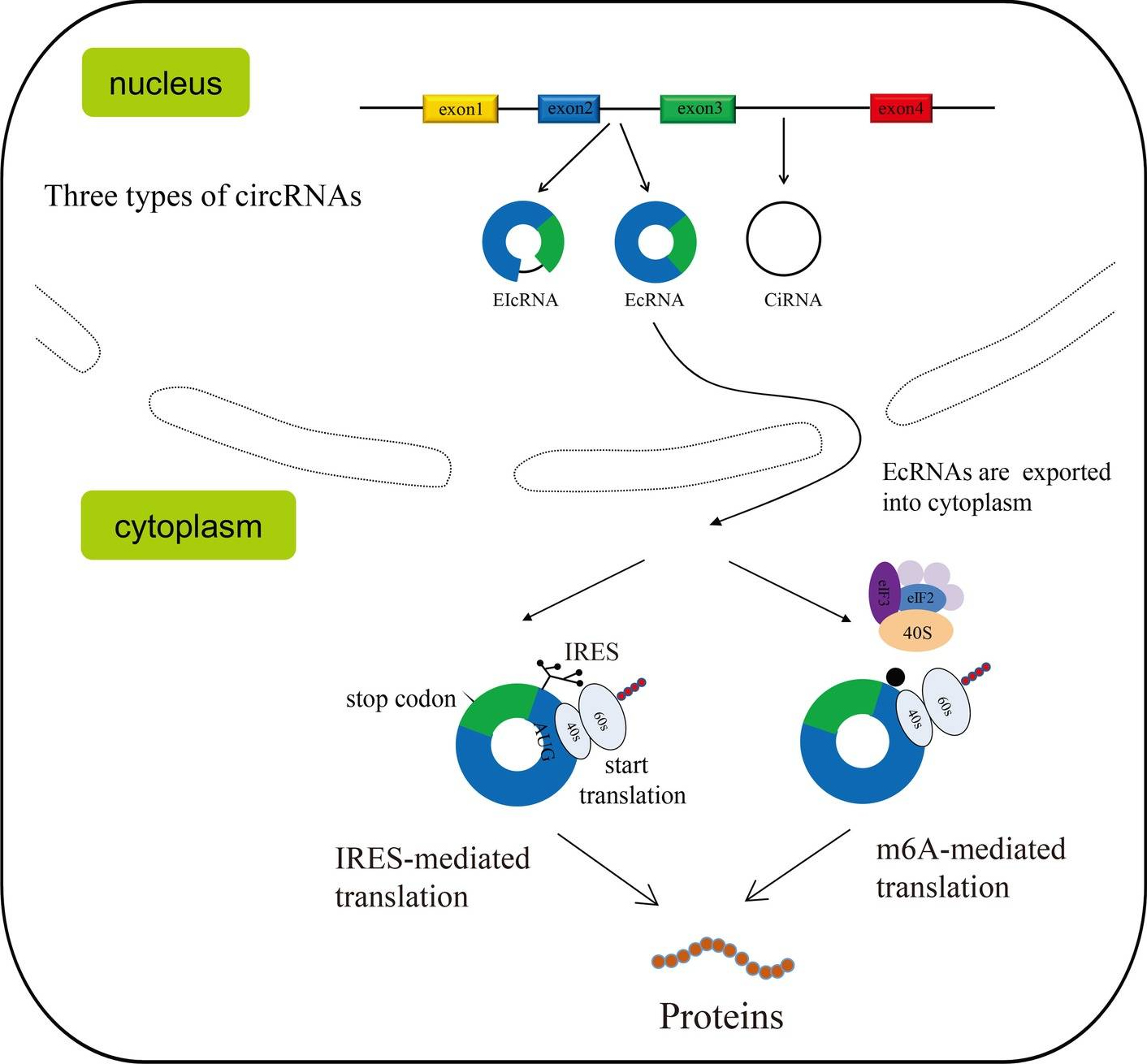
依据circRNAs包含的序列类型可分为三种不同的类型:外显子circRNAs(EcRNA)、内含子circRNAs(CiRNA)和外显子-内含子circRNAs(EIcRNA)。其中,IRES和m6A介导的翻译起始都是circRNA翻译的重要机制(图1)。
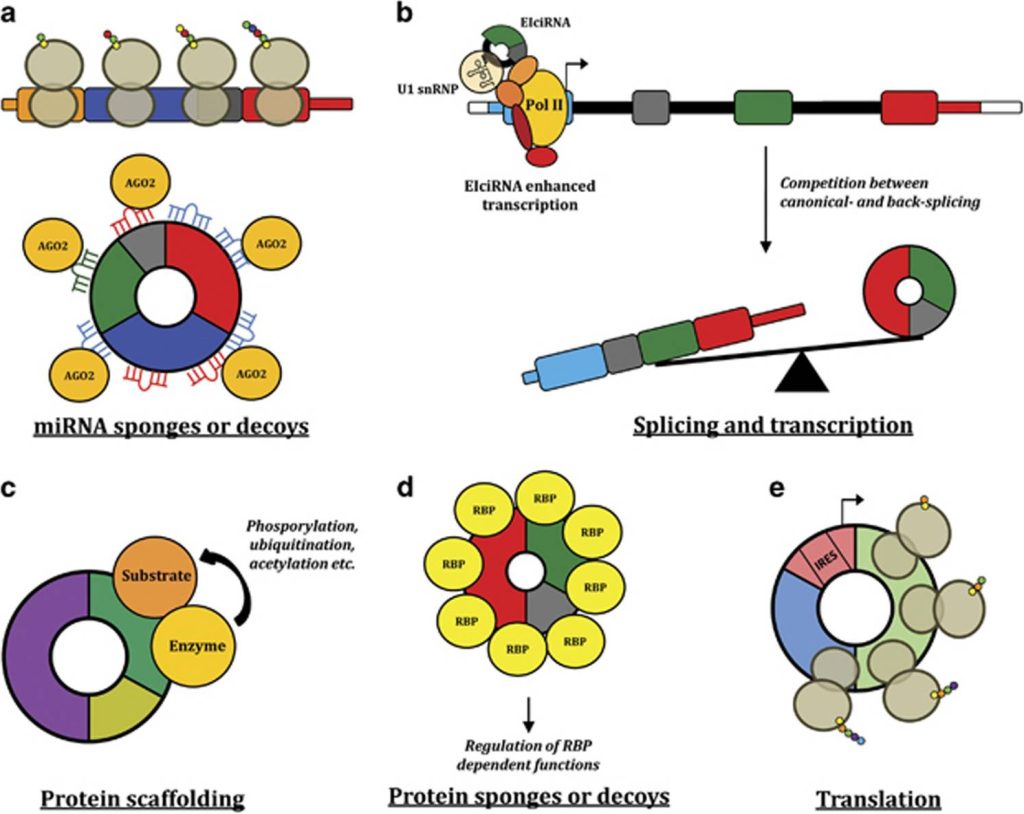
图2 circRNA在恶性肿瘤中的功能(Kristensen et al., 2018)。
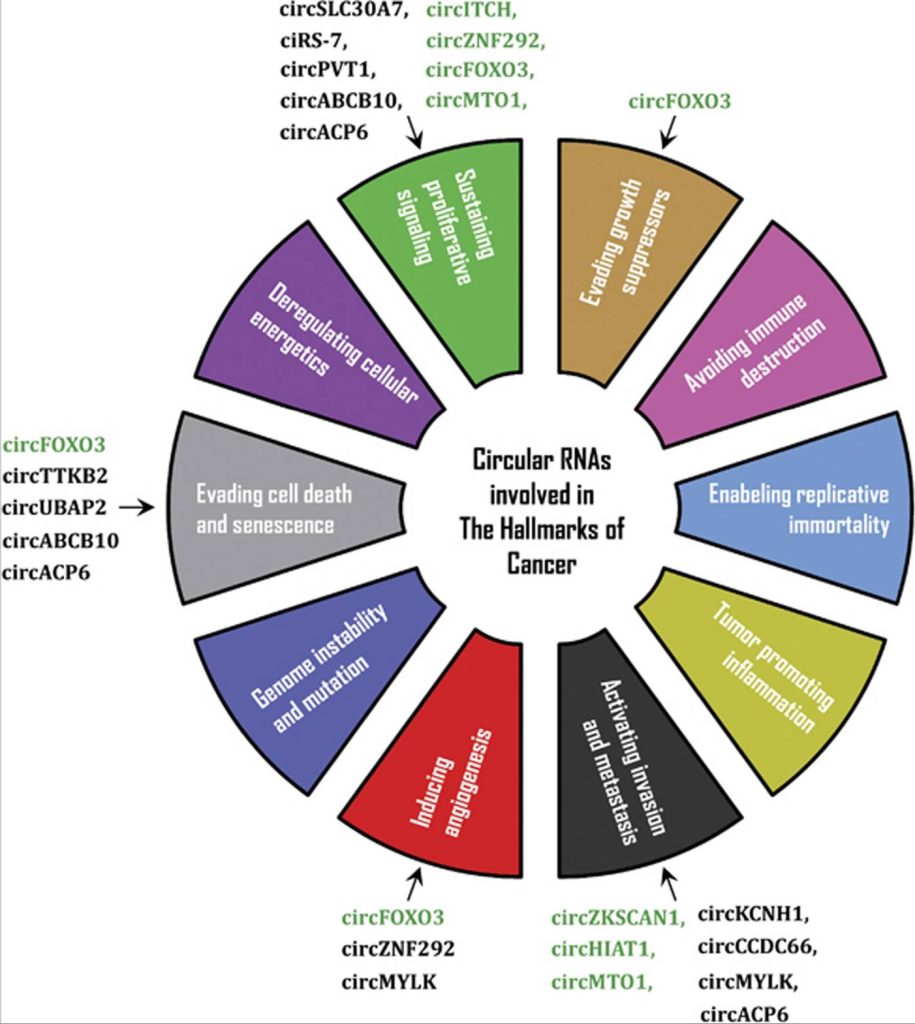
目前,circRNAs与癌症的几个标志有关(图3)。目前,研究较多的一种circRNA来源于肿瘤抑制基因Foxo3,并已被发现通过各种机制促进肿瘤细胞凋亡(Yang et al., 2016)。与circFoxo3不同,来自TTBK2和UBAP2的circRNA已被证明可抑制细胞凋亡(Zheng et al., 2017)。circMYLK是circRNA的另一个例子,可通过VEGFA/VEGFR2信号通路促进血管生成(Zhong et al., 2017)。
随着生物信息学技术的发展,越来越多的研究表明,circRNAs的失调参与了包括cRCC在内的恶性肿瘤的发病机制。
在本文中,作者通过探究circPOLR2A在cRCC中的异常表达与其在体外对细胞增殖、迁移、侵袭和凋亡的影响及其在cRCC细胞中与PEBP1的相互作用,发现PEBP1是circPOLR2A下游靶蛋白,且UBE3C是一种特异性泛素E3连接酶,参与PEBP1泛素化。进一步的,circPOLR2A不仅加强了细胞中UBE3C和PEBP1之间的相互作用还参与cRCC中ERK通路的激活和血管生成以及促进cRCC细胞在体内的生长和转移;同时,YTHDF2对circPOLR2A的表达起抑制作用,这与m6A修饰有关(图4)。
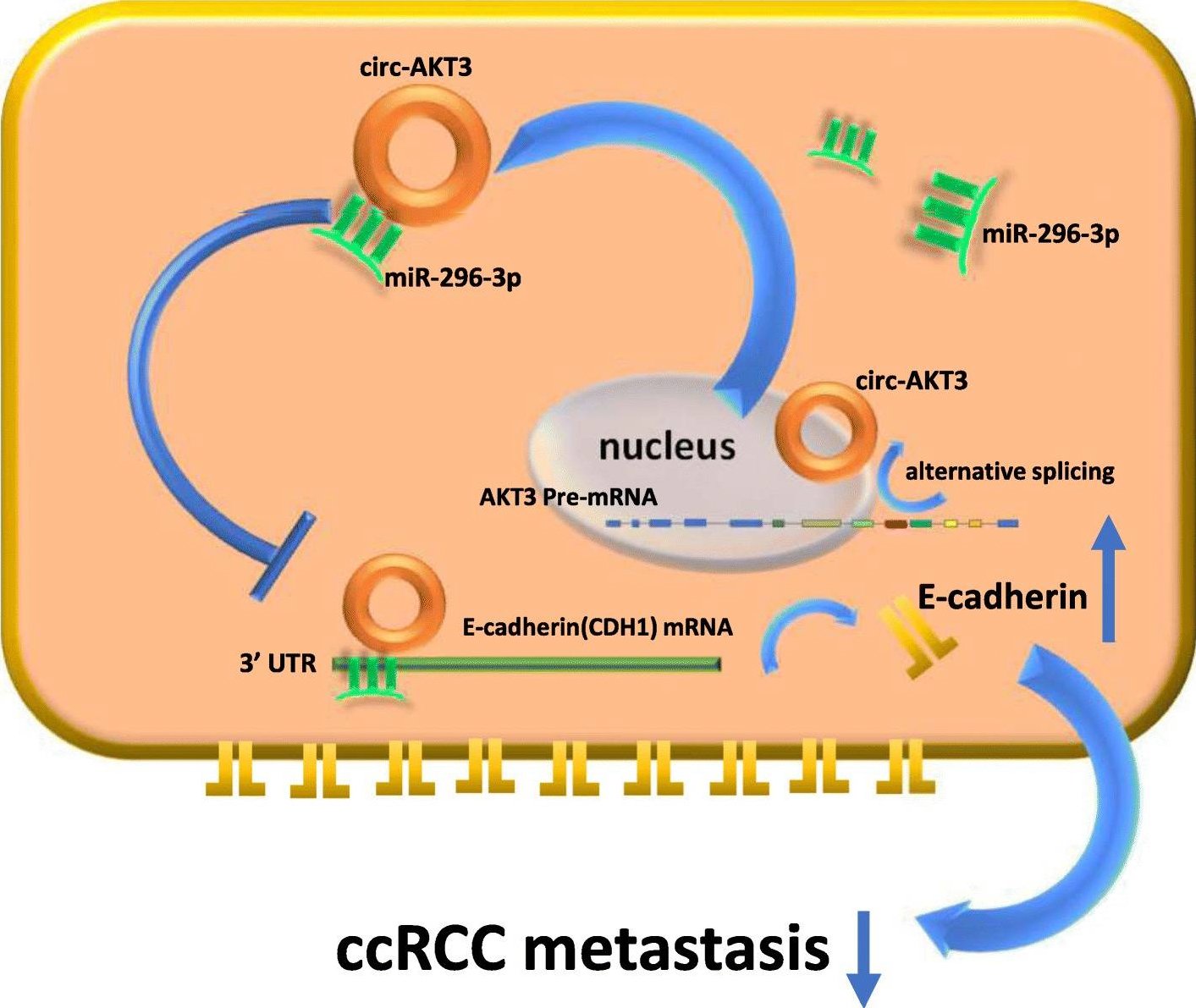
在本文中,作者通过Arraystar Human circRNA芯片发现了一个新的来源于AKT3基因位点的circRNA,将其命名为circ-AKT3,并通过qPC验证了其在60个cRCC组织和邻近正常组织以及cRCC细胞系和人正常肾细胞中的表达。之后,体内外的功能性实验表明,circ-AKT3的敲低促进了cRCC恶性肿瘤的迁移和侵袭,而circ-AKT3的过表达则发挥抑制作用,这与circ-AKT3通过竞争性结合miR-296-3p强制E-cadherin表达相关(图5)。
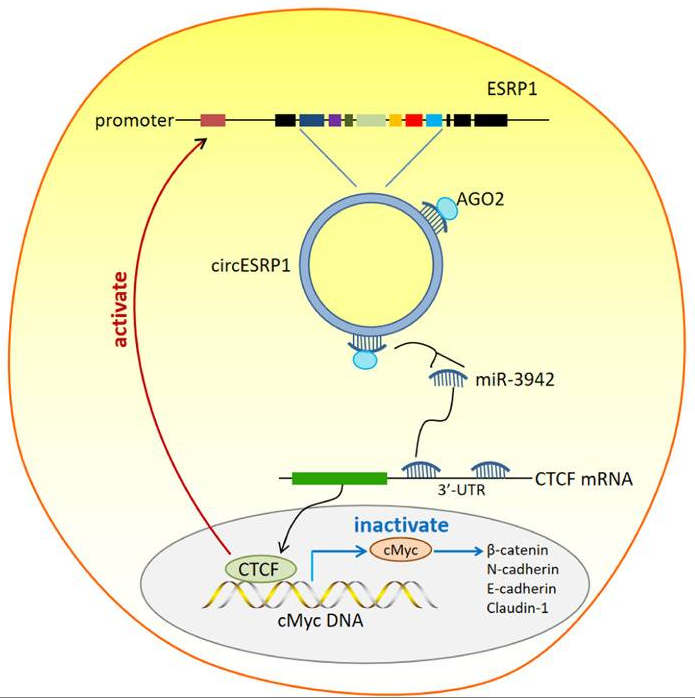
在本文中,作者通过分析来自GEO数据库RCC组织中的circRNA表达谱,鉴定出了一种源自8q22.1外显子ESRP1基因位点的新型circRNA——circESRP1,其表达水平与cRCC晚期肿瘤大小、TNM分期以及远处转移呈负相关;在79个cRCC组织中,circESRP1表达水平与CTCF蛋白呈正相关,但与miR-3942呈负相关。体内实验发现circESRP1的过表达有效地抑制了异种移植肿瘤的生长并抑制了c-Myc介导的EMT进展(图6)。
Lei M, Zheng G, Ning Q, et al. Translation and functional roles of circular RNAs in human cancer. Mol Cancer. 2020;19(1):30.
Sanger HL, Klotz G, Riesner D, et al. Viroids are single-stranded covalently closed circular RNA molecules existing as highly base-paired rod-like structures. Proc Natl Acad Sci U S A. 1976;73(11):3852-3856.
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-249.
Xu Z, Chen S, Liu R, et al. Circular RNA circPOLR2A promotes clear cell renal cell carcinoma progression by facilitating the UBE3C-induced ubiquitination of PEBP1 and, thereby, activating the ERK signaling pathway. Mol Cancer. 2022;21(1):146.
Xue D, Wang H, Chen Y, et al. Circ-AKT3 inhibits clear cell renal cell carcinoma metastasis via altering miR-296-3p/E-cadherin signals. Mol Cancer. 2019;18(1):151.
Yang W, Du WW, Li X, et al. Foxo3 activity promoted by non-coding effects of circular RNA and Foxo3 pseudogene in the inhibition of tumor growth and angiogenesis. Oncogene. 2016;35(30):3919-3931.
Zheng J, Liu X, Xue Y, et al. TTBK2 circular RNA promotes glioma malignancy by regulating miR-217/HNF1β/Derlin-1 pathway. J Hematol Oncol. 2017;10(1):52.
Zhong Z, Huang M, Lv M, et al. Circular RNA MYLK as a competing endogenous RNA promotes bladder cancer progression through modulating VEGFA/VEGFR2 signaling pathway. Cancer Lett. 2017;403:305-317.