doi: 10.1186/s12974-021-02316-7.
Interleukin-10 improves stroke outcome by controlling the detrimental Interleukin-17A response
背景:Lymphocytes have dichotomous functions in ischemic stroke. Regulatory T cells are protective, while IL-17A from innate lymphocytes promotes the infarct growth. With recent advances of T cell-subtype specifc transgenic mouse models it now has become possible to study the complex interplay of T cell subpopulations in ischemic stroke.
方法:In a murine model of experimental stroke we analyzed the efects of IL-10 on the functional outcome for up to 14 days post-ischemia and defned the source of IL-10 in ischemic brains based on immunohistochemistry, fow cytometry, and bone-marrow chimeric mice. We used neutralizing IL-17A antibodies, intrathecal IL-10 injections, and transgenic mouse models which harbor a deletion of the IL-10R on distinct T cell subpopulations to further explore the interplay between IL-10 and IL-17A pathways in the ischemic brain.
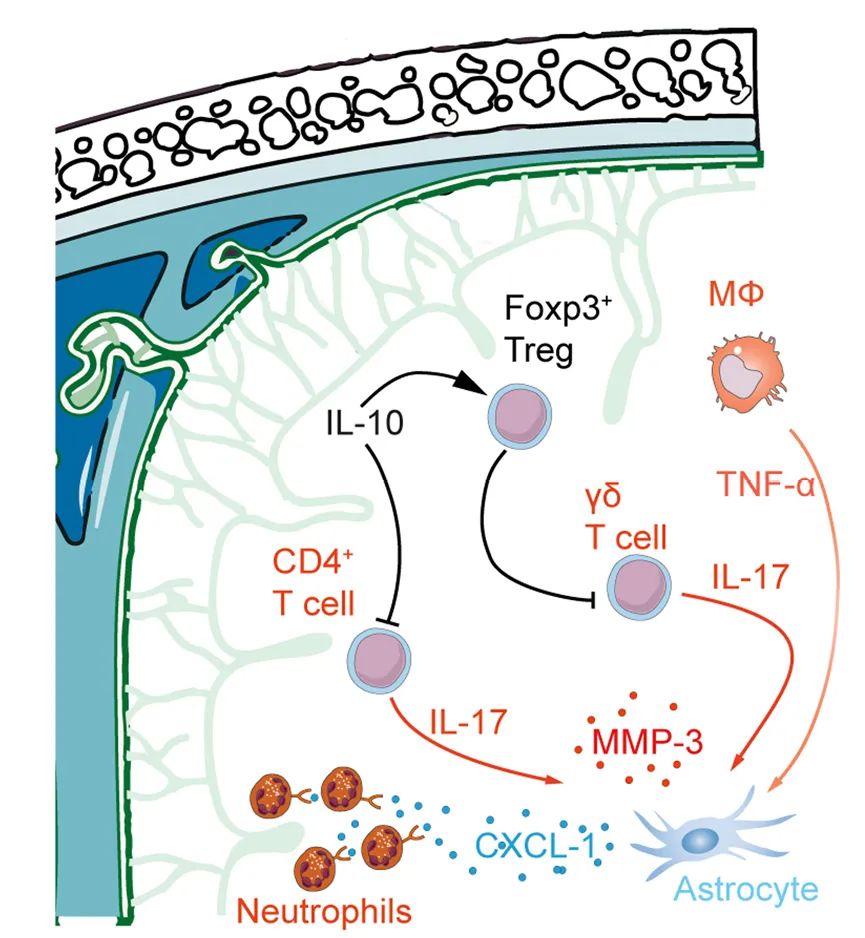
结果:We demonstrate that IL-10 defcient mice exhibit signifcantly increased infarct sizes on days 3 and 7 and enlarged brain atrophy and impaired neurological outcome on day 14 following tMCAO. In ischemic brains IL-10 producing immune cells included regulatory T cells, macrophages, and microglia. Neutralization of IL-17A following stroke reversed the worse outcome in IL-10 defcient mice and intracerebral treatment with recombinant IL-10 revealed that IL-10 controlled IL-17A positive lymphocytes in ischemic brains. Importantly, IL-10 acted diferentially on αβ and γδ T cells. IL-17A producing CD4+ αβ T cells were directly controlled via their IL-10-receptor (IL-10R), whereas IL-10 by itself had no direct efect on the IL-17A production in γδ T cells. The control of the IL-17A production in γδ T cells depended on an intact IL10R signaling in regulatory T cells (Tregs).
结论:Taken together, our data indicate a key function of IL-10 in restricting the detrimental IL-17A-signaling in stroke and further supports that IL-17A is a therapeutic opportunity for stroke treatment.
关键词:Stroke, Ischemia, Infammation, T cells, Interleukin-10, Interleukin-17

