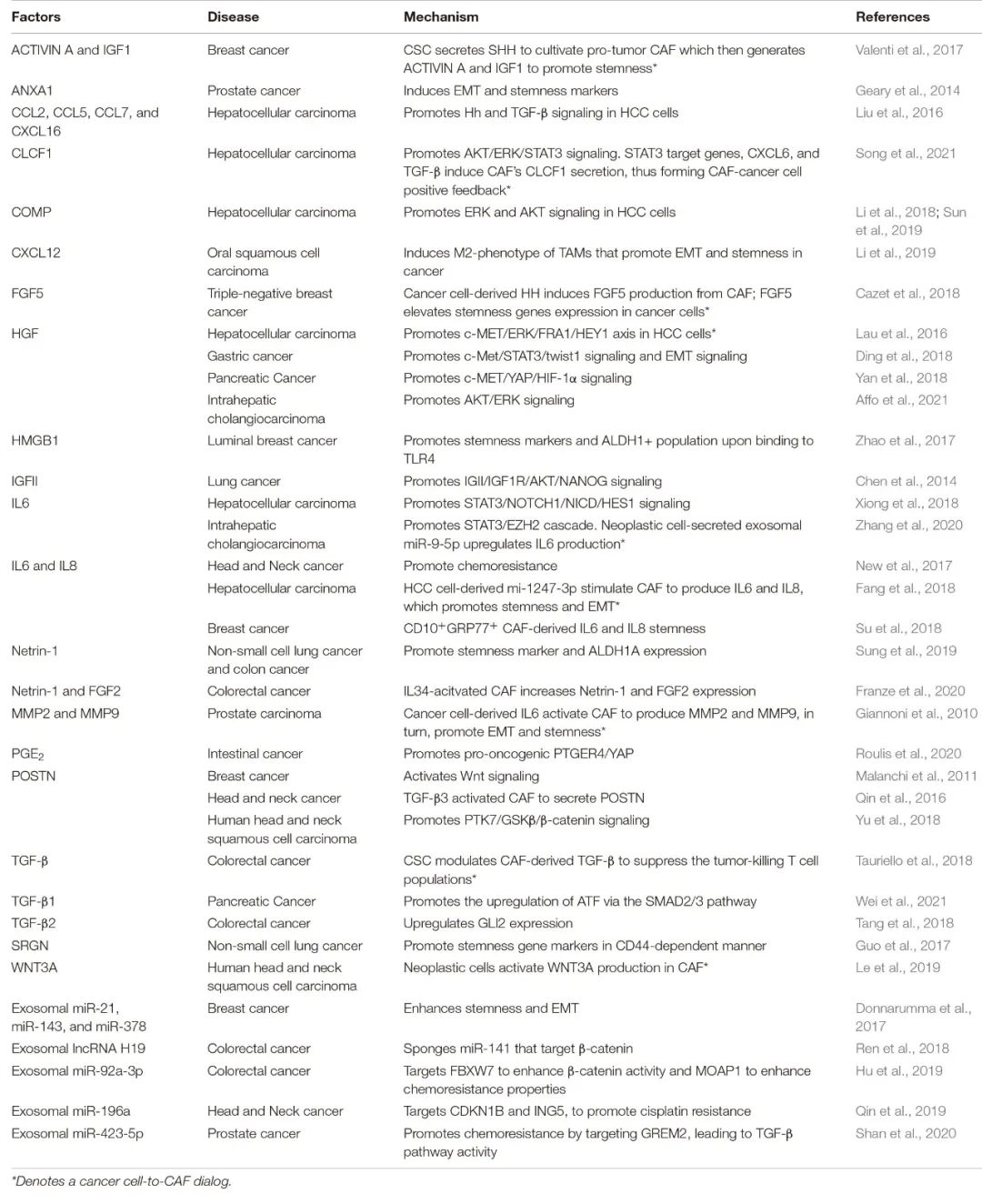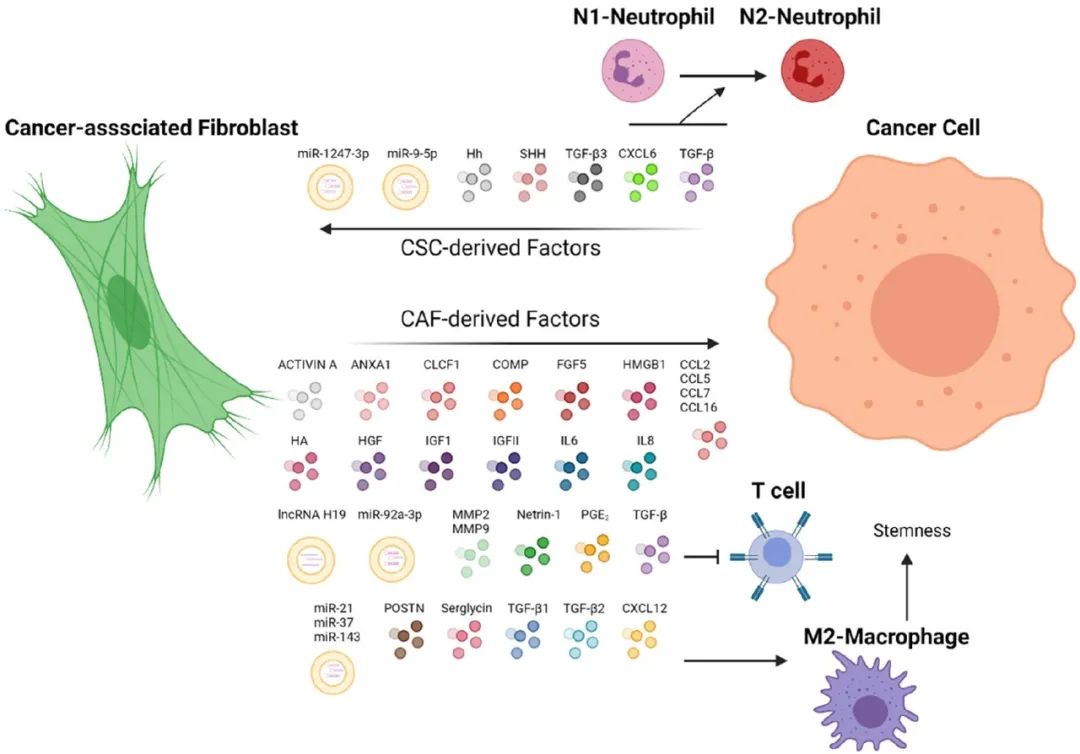
表 与CSC相关的CAF衍生因子
题目
The Role of Cancer-Associated Fibroblast as a Dynamic Player in Mediating Cancer Stemness in the Tumor Microenvironment
The enrichment of cancer-associated fibroblast (CAFs) in a tumor microenvironment (TME) cultivates a pro-tumorigenic niche via aberrant paracrine signaling and matrix remodeling. A favorable niche is critical to the maintenance of cancer stem cells (CSCs), a population of cells that are characterized by their enhanced ability to self-renew, metastasis, and develop therapy resistance. Mounting evidence illustrates the interplay between CAF and cancer cells expedites malignant progression. Therefore, targeting the key cellular components and factors in the niche may promote a more efficacious treatment. In this study, we discuss how CAF orchestrates a niche that enhances CSC features and the potential therapeutic implication.