
doi: 10.1186/s13148-021-01187-2.
题目
H3K36 trimethylation-mediated biological functions in cancer
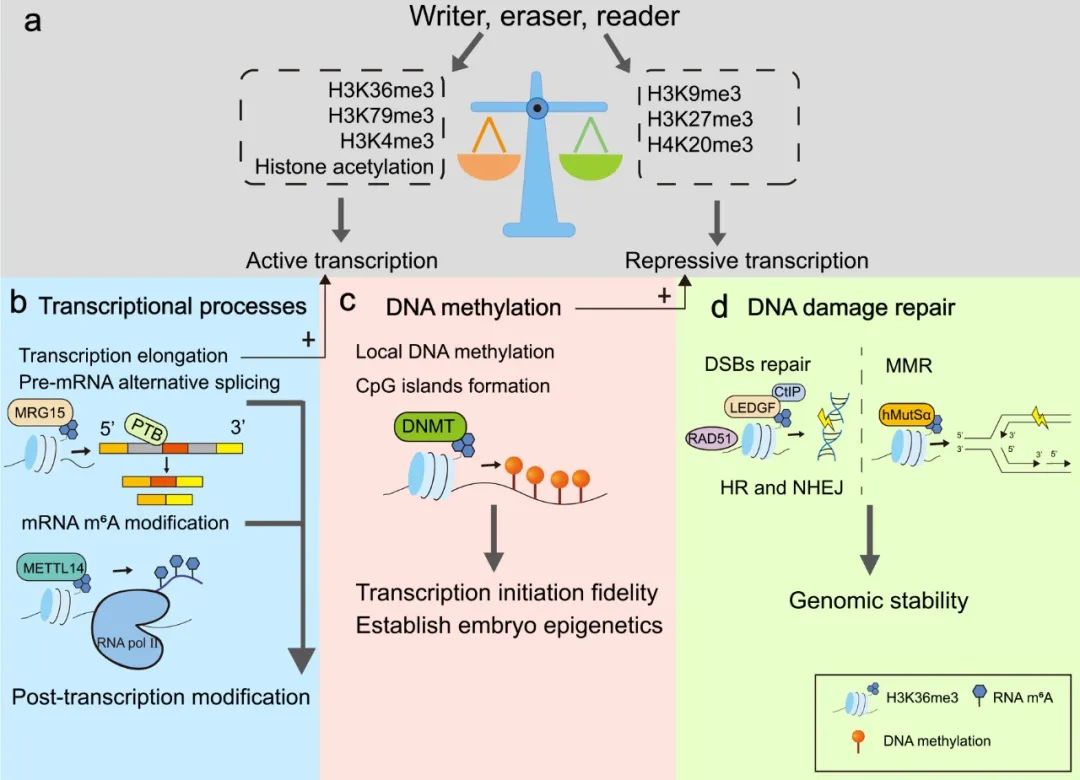
Histone modification is an important form of epigenetic regulation. Thereinto, histone methylation is a critical determination of chromatin states, participating in multiple cellular processes. As a conserved histone methylation mark, histone 3 lysine 36 trimethylation (H3K36me3) can mediate multiple transcriptional-related events, such as the regulation of transcriptional activity, transcription elongation, pre-mRNA alternative splicing, and RNA m6A methylation. Additionally, H3K36me3 also contributes to DNA damage repair. Given the crucial function of H3K36me3 in genome regulation, the roles of H3K36me3 and its sole methyltransferase SETD2 in pathogenesis, especially malignancies, have been emphasized in many studies, and it is conceivable that disruption of histone methylation regulatory network composed of “writer”, “eraser”, “reader”, and the mutation of H3K36me3 codes have the capacity of powerfully modulating cancer initiation and development. Here we review H3K36me3-mediated biological processes and summarize the latest findings regarding its role in cancers. We highlight the significance of epigenetic combination therapies in cancers.
关键词:Histone modification, H3K36me3, Solid tumor, Epigenetic therapy

