Cell Death Dis. 2021 Oct 30.
doi: 10.1038/s41419-021-04324-0.
题目
MicroRNA-106a regulates autophagy-related cell death and EMT by targeting TP53INP1 in lung cancer with bone metastasis
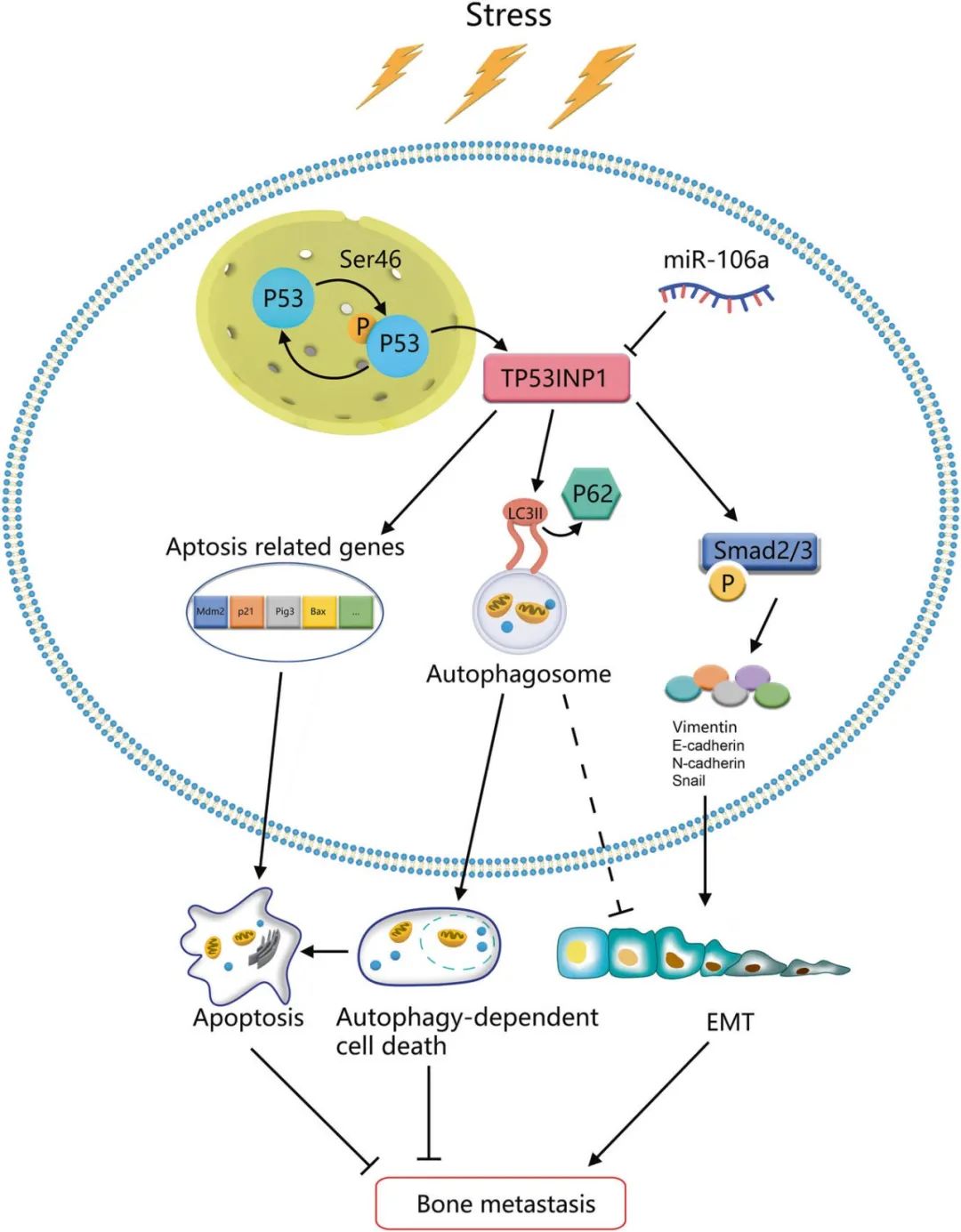
Bone metastasis is one of the most serious complications in lung cancer patients. MicroRNAs (miRNAs) play important roles in tumour development, progression and metastasis. A previous study showed that miR-106a is highly expressed in the tissues of lung adenocarcinoma with bone metastasis, but its mechanism remains unclear. In this study, we showed that miR-106a expression is dramatically increased in lung cancer patients with bone metastasis (BM) by immunohistochemical analysis. MiR-106a promoted A549 and SPC-A1 cell proliferation, migration and invasion in vitro. The results of bioluminescence imaging (BLI), micro-CT and X-ray demonstrated that miR-106a promoted bone metastasis of lung adenocarcinoma in vivo. Mechanistic investigations revealed that miR-106a upregulation promoted metastasis by targeting tumour protein 53-induced nuclear protein 1 (TP53INP1)-mediated metastatic progression, including cell migration, autophagy-dependent death and epithelial-mesenchymal transition (EMT). Notably, autophagy partially attenuated the effects of miR-106a on promoting bone metastasis in lung adenocarcinoma. These findings demonstrated that restoring the expression of TP53INP1 by silencing miR-106a may be a novel therapeutic strategy for bone metastatic in lung adenocarcinoma.