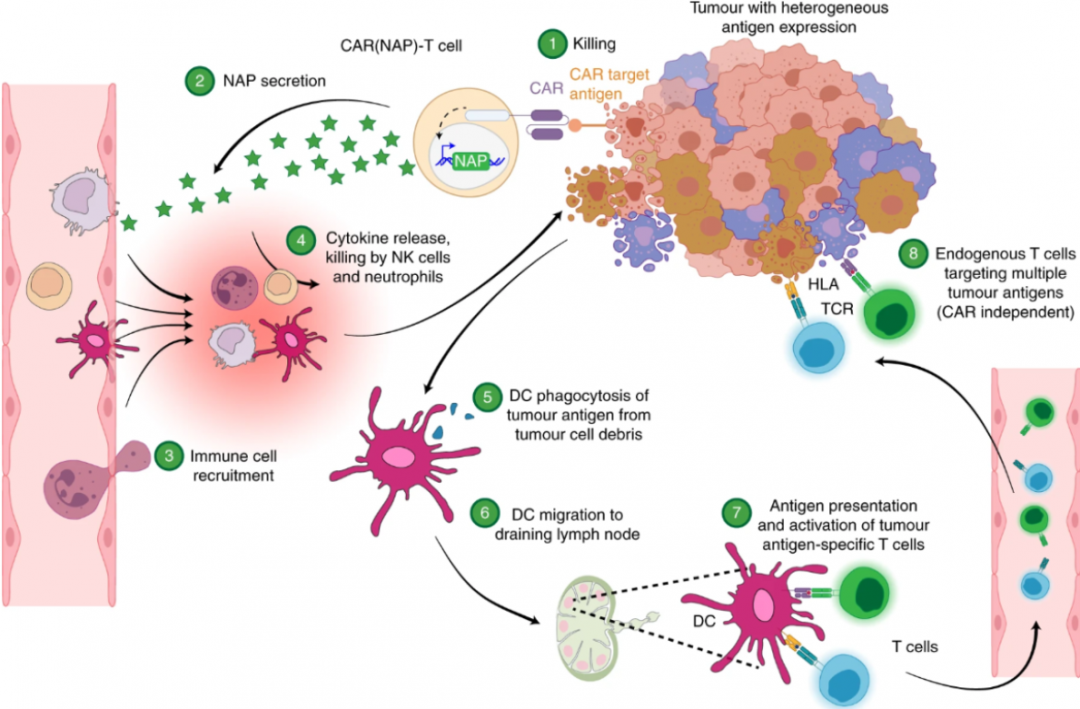
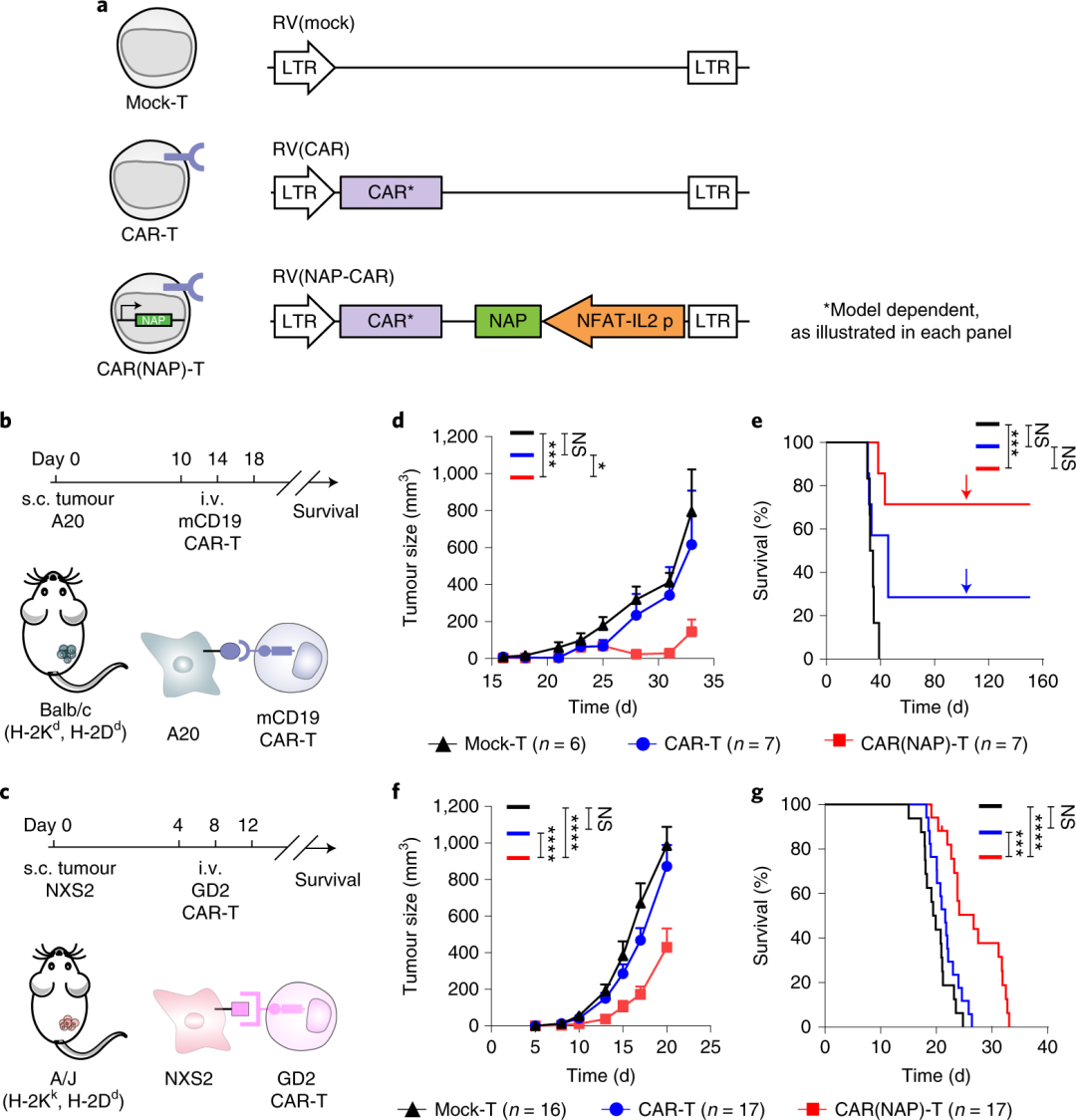
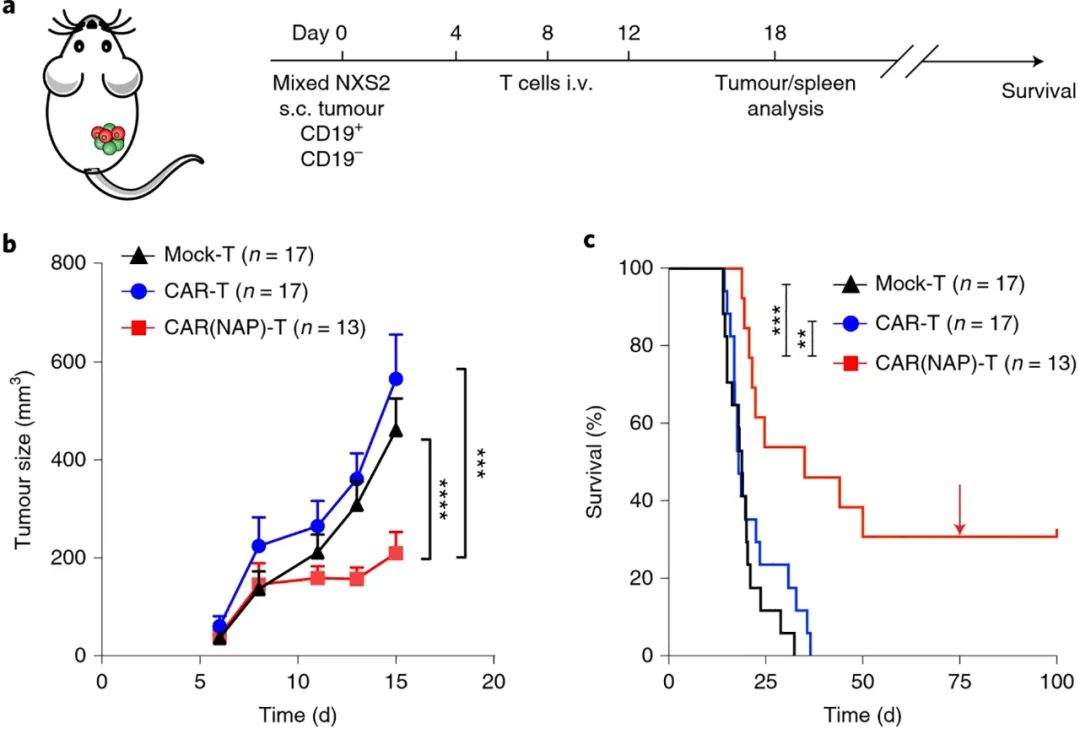
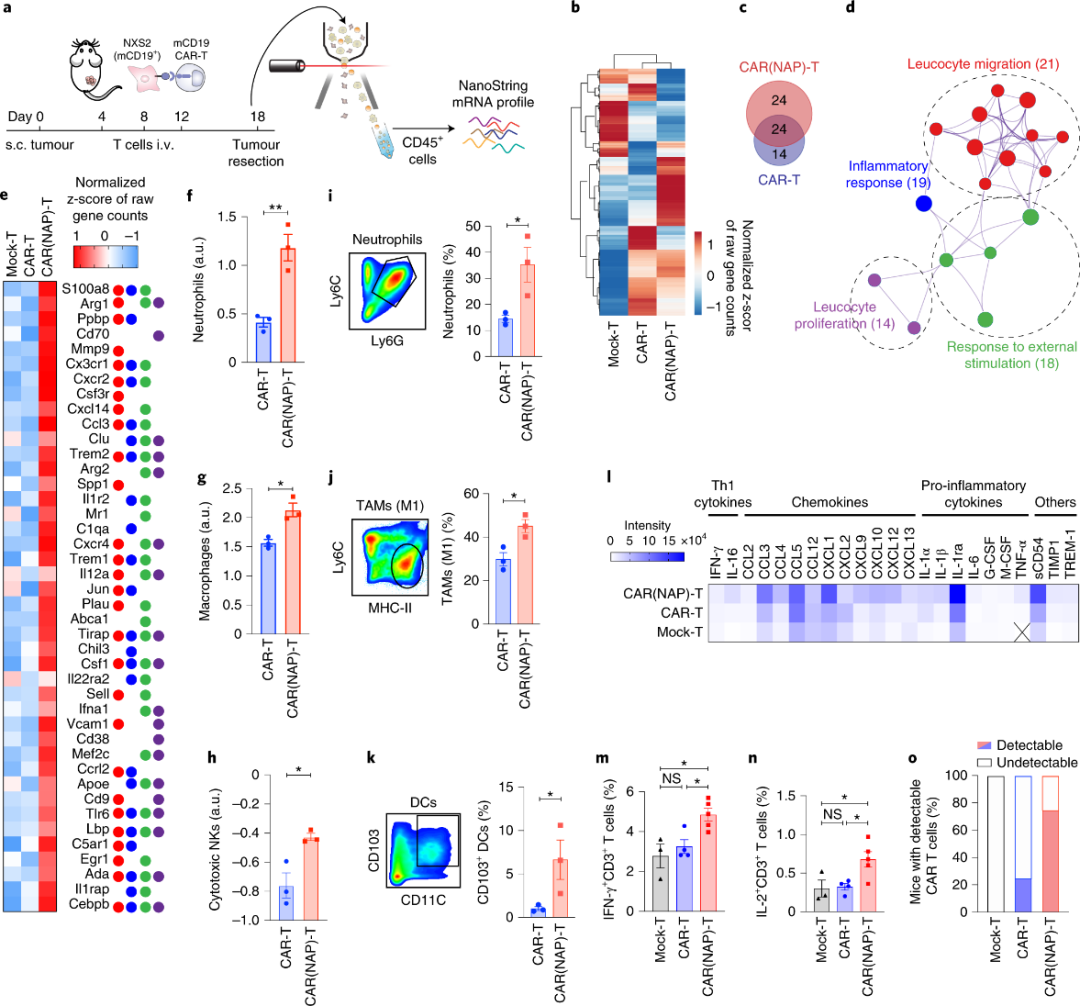
2022年4月1日,瑞典乌普萨拉大学Magnus Essand团队在Nature Biomedical Engineering上发表了“CAR T cells expressing a bacterial virulence factor trigger potent bystander antitumour responses in solid cancers”一文。在本研究中,介于幽门螺杆菌的中性粒细胞激活蛋白(NAP)可吸引先天免疫细胞,诱导DC细胞成熟以及Th1细胞极化,创建由IL-12产发的局部促炎环境,团队通过从幽门螺杆菌中引入编码免疫刺激蛋白NAP基因,武装CAR-T细胞,致使NAP从CAR-T细胞中释放时产生的促炎环境,直接对抗实体瘤中的免疫抑制微环境,加强CAR-T细胞功能(图1)。团队认为“NAP武装CAR-T细胞”这项新技术有可能彻底改变CAR-T细胞治疗。
接下来,就跟随小编一起来看看团队为了研究CAR(NAP)-T细胞的作用,进行了哪些实验,又得到了哪些结论吧!
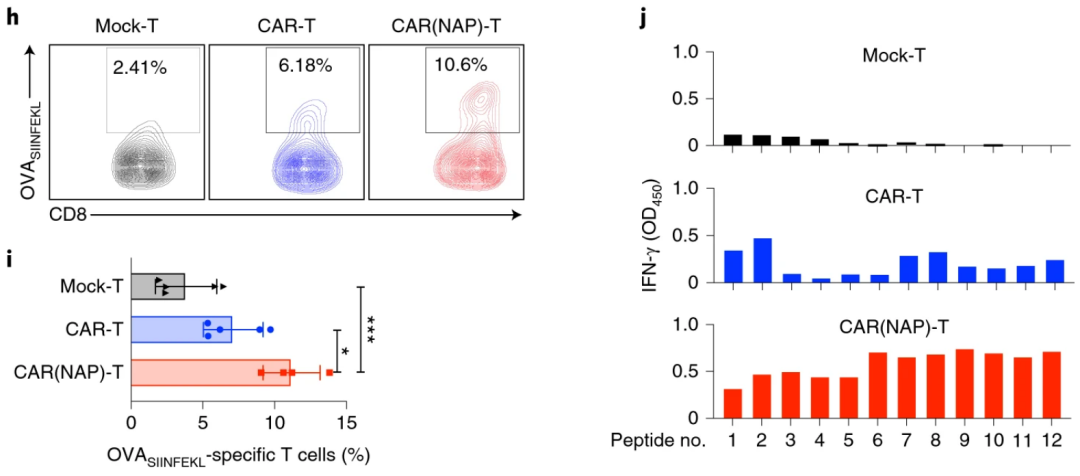
总的来说,这些观察结果表明,与传统CAR-T细胞相比,用CAR(NAP)T细胞治疗会诱导更明显的免疫“热”、Th1型促炎性肿瘤微环境,这解释了CAR(NAP)T细胞的卓越治疗效果。
上述观察结果与公布的数据一致,即作为重组蛋白(Codolo et al. 2012)或作为治疗性转基因(Ramachandran et al. 2013)递送的NAP可促进DC成熟与Th1极化,并招募和激活单核细胞和中性粒细胞(Amedei et al. 2006)。因此,团队提出CAR(NAP)T细胞治疗功效的增强与分泌型NAP吸引及激活先天免疫细胞以杀死肿瘤细胞的能力有关,其可激活DC以促进表位扩散诱导,从而导致CAR靶向非依赖性CD8+ T细胞旁观免疫。
Alexandrov LB, Nik-Zainal S, Wedge DC, et al. Signatures of mutational processes in human cancer. Nature. 2013;500(7463):415-421.
Chen J, López-Moyado IF, Seo H, et al. NR4A transcription factors limit CAR T cell function in solid tumours. Nature. 2019;567(7749):530-534.
Codolo G, Fassan M, Munari F, et al. HP-NAP inhibits the growth of bladder cancer in mice by activating a cytotoxic Th1 response. Cancer Immunol Immunother. 2012;61(1):31-40.
Jin C, Ma J, Ramachandran M, et al. CAR T cells expressing a bacterial virulence factor trigger potent bystander antitumour responses in solid cancers. Nat Biomed Eng. 2022 Apr 4.