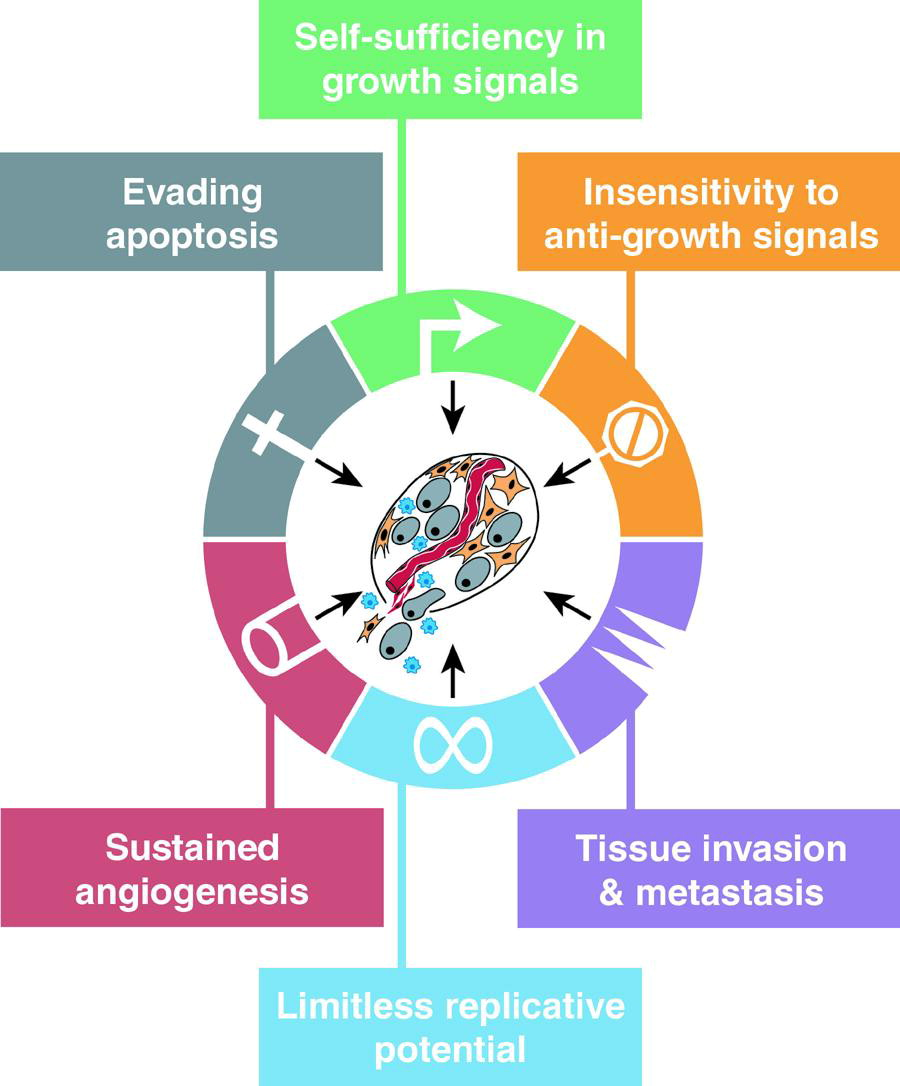
1、后天能力——增长信号的自给自足
正常细胞需要有丝分裂生长信号(GS)才能从静止状态进入活跃的增殖状态,而获得GS自主性是癌症研究人员明确定义的六种特性的第一种,这在很大程度上是因为已发现可调节它的显性癌基因普遍存在。获得性GS自主性的最复杂机制源自下游细胞质通路的改变,SOS-Ras-Raf-MAPK级联反应在这里起核心作用。
2、后天能力——对抗生长信号不敏感
在正常组织内,多种抗增殖信号发挥维持细胞静止和组织稳态的作用,其可通过两种不同的机制阻止细胞增殖,癌细胞初期的增殖需避开这些抗增殖信号。在分子水平上,许多甚至可能所有的抗增殖信号都通过pRb及其两个近亲p107和p130传递。
3、获得能力——逃避细胞凋亡
肿瘤细胞群扩大数量的能力不仅取决于细胞增殖率,还取决于细胞损耗率,而程序性细胞死亡(细胞凋亡)是这种损耗的主要来源,即获得性对细胞凋亡的抵抗是大多数甚至所有类型癌症的标志。许多引发细胞凋亡的信号都集中在线粒体上,线粒体可通过释放细胞色素C来响应促凋亡信号。癌细胞可通过多种策略获得对细胞凋亡的抵抗力。
4、后天能力——无限的复制潜力
研究发现,许多甚至所有类型的哺乳动物细胞都带有一种内在的、细胞自主的程序,限制了它们的繁殖,该程序似乎独立于上述细胞间信号通路。大多数在培养中繁殖的肿瘤细胞似乎是永生的,这表明无限的复制潜力是一种在肿瘤进展过程中在体内获得的表型,并且对于其恶性生长状态的发展至关重要。过去的研究已证实,端粒维护是无限复制能力的关键组成部分,规避细胞衰老代表了肿瘤进展中的一个重要步骤。
5、获得能力——持续的血管生成
脉管系统提供的氧气和营养对细胞功能和存活至关重要,几乎组织中的所有细胞都必须驻留在毛细血管的100μm范围内。异常增殖性病变中的细胞最初缺乏血管生成能力,从而限制了它们的扩张能力,因此,早期瘤形成必须发展血管生成能力。诱导和维持血管生成的能力是在肿瘤发展过程中通过来自血管静止的“血管生成开关”在一个(或多个)离散步骤中获得的,肿瘤可通过改变血管生成诱导剂和抵消抑制剂的平衡来激活血管生成开关。
6、获得能力——组织侵袭和转移
侵袭和转移的相互关联是癌细胞的一种能力,在具有侵袭或转移能力的细胞中,参与将细胞与其周围环境联系在一起的几类蛋白质在组织中发生了改变,其中,细胞外蛋白酶的激活和钙粘蛋白、CAM和整合素结合特异性的改变是获得侵袭性和转移能力的核心。
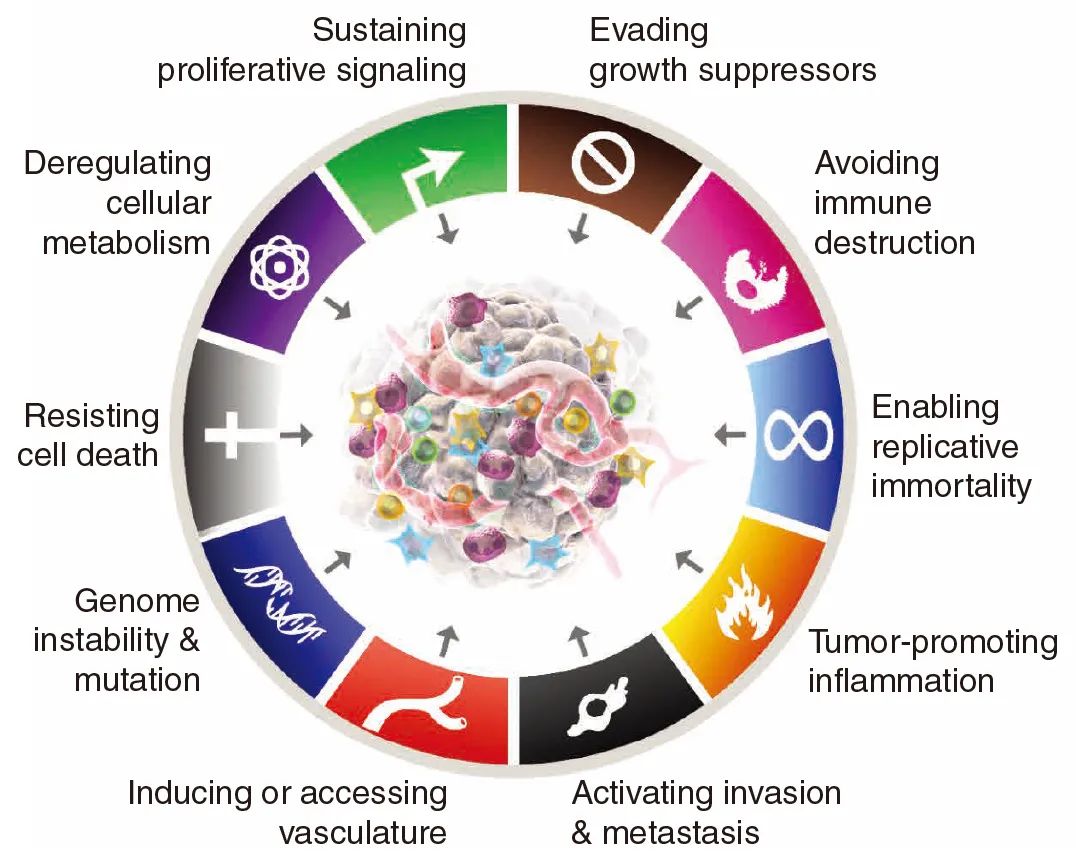
本次更新内容如下:
(1)癌细胞增殖能力的研究,包括调控通路、体细胞突变、反馈机制中的缺陷;
(2)抗生长信号的研究,包括生长抑制因子、接触抑制机制与逃避、TGF-β通路的破坏;
(3)细胞死亡机制研究,包括细胞凋亡、自噬介导的肿瘤细胞存活和死亡、细胞坏死与炎症反应;
(4)无限复制潜力研究,包括延伸端粒DNA以及端粒酶的新功能与端粒维护;
(5)诱导血管生成,包括血管生成开关及其分级、内源性血管生成抑制剂、周细胞与多种骨髓源细胞功能;
(6)激活侵袭和转移,包括E-cadherin等相关因子的作用、上皮-间质转化(EMT)机制、基质细胞异型贡献、侵袭细胞可塑性、侵袭类型与肿瘤关系、转移定植的复杂性。
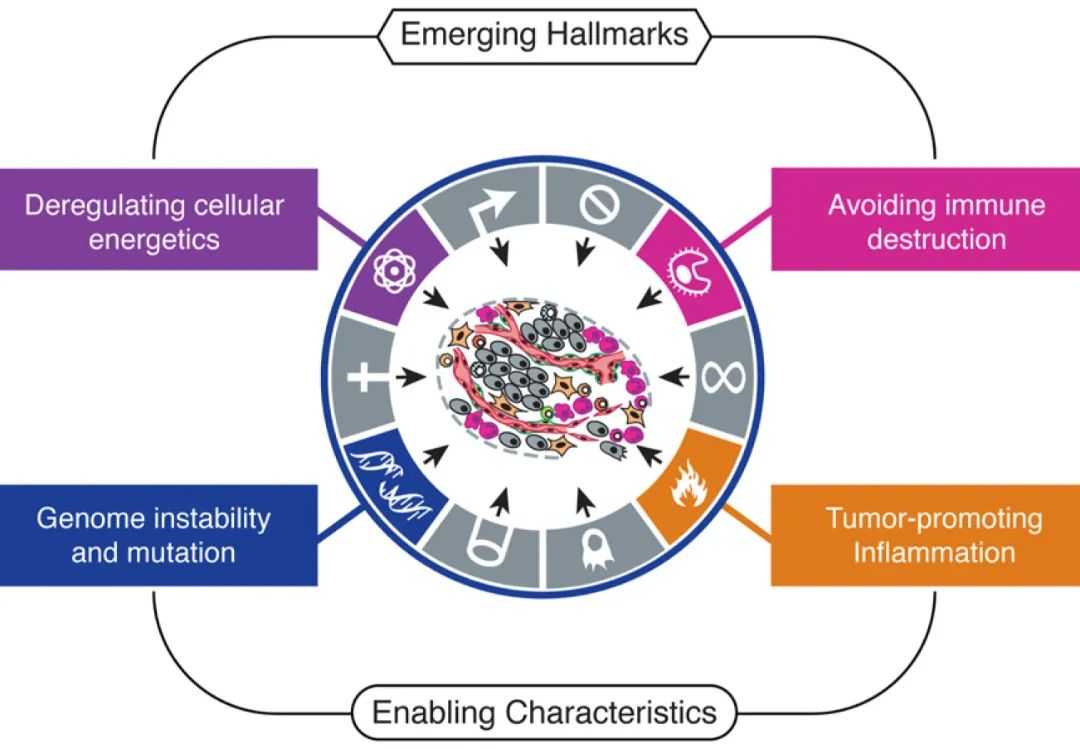
能量代谢的重新编程
细胞能量代谢的重新编程可支持持续的细胞生长和增殖,取代大多数正常组织中运作的代谢程序,并为相关细胞的生理运作提供燃料。癌细胞基因组分子遗传学分析的进展为功能改变突变和肿瘤进展过程中持续的基因组不稳定性提供了最引人注目的证明,基因组中特定位点的特定畸变(扩增和缺失)的复发表明这些位点可能含有改变利于肿瘤进展的基因。提出基因组不稳定性是与获得标志性能力有因果关系的一个特征。
已有研究证明,即使在有氧条件下,癌细胞也可通过将其能量代谢主要限制为糖酵解来重编程其葡萄糖代谢,从而重新编程其能量产生,进而形成“有氧糖酵解”状态。已经发现一些肿瘤包含两个癌细胞亚群,它们的能量产生途径不同,一个亚群由分泌乳酸的葡萄糖依赖性(“Warburg效应”)细胞组成,另一个亚群的细胞优先导入和利用其“邻居”产生的乳酸作为主要能源,可利用部分柠檬酸循环。也就是说,能量代谢的重编程在很大程度上是由以一种或另一种方式参与编程癌症核心标志的蛋白质协调的。
逃避免疫破坏
随着准确识别免疫系统不同细胞类型标记物的出现,几乎每个肿瘤病变都存在只能用特异性抗体检测到的免疫细胞,并且许多肿瘤类型的抗肿瘤反应也伴随着免疫逃逸,炎症可通过向肿瘤微环境提供生物活性分子来促进多种标志性能力。
近年来,来自基因工程小鼠和临床流行病学越来越多的证据表明,免疫系统是肿瘤形成和进展的重要屏障,至少在某些形式的非病毒诱导的癌症中是这样的。具体表现为,免疫系统的先天和适应性细胞都能显著促进免疫监视,从而根除肿瘤。
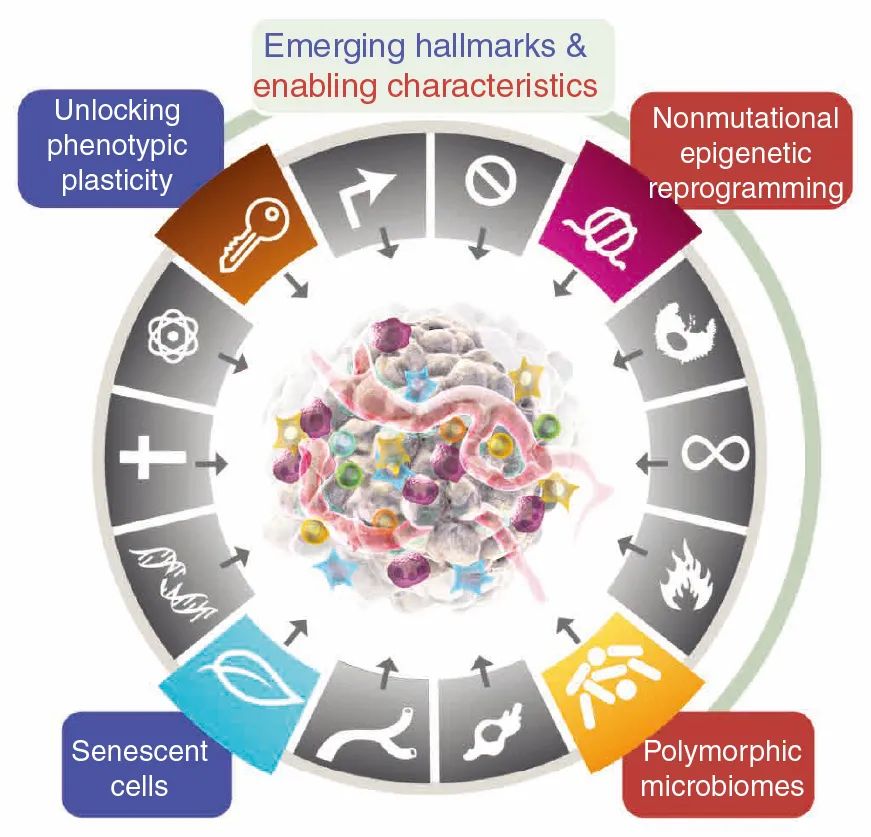
图3 第三版肿瘤新兴标志示意图。
解锁表型可塑性
在器官发生过程中,细胞分化的最终结果在大多数情况下是抗增殖的,并且构成了对肿瘤形成所必需的持续增殖的明显障碍。越来越多的证据表明,为了逃避终末分化状态,释放受限表型可塑性能力是癌症发病机制的关键组成部分,并且这种可塑性有多种表现形式,包括:去分化、抑制分化与转分化。
非突变表观遗传重编程
DNA不稳定性和突变的使能特征是癌症形成和发病机制的基本组成部分。此外,还有另一种明显独立的基因组重编程模式,该模式涉及基因表达的纯表观遗传调节变化,称为“非突变表观遗传重编程”,其已被确立为介导胚胎发育、分化和器官发生的核心机制。同时,报道指出,涉及表观遗传重编程的只要机制为微环境、表观遗传调控异质性(如:DNA甲基化、组蛋白修饰、染色质可及性及RNA的转录后修饰和翻译)、填充肿瘤微环境的辅助细胞类型。
多态微生物组
揭示微生物群的多样性和变异性作为目前生物医学研究的前沿领域,它们与暴露于外部环境的身体屏障组织(尤其是表皮和内部黏膜)共生,特别是胃肠道、肺、乳房和泌尿生殖系统。由常驻微生物组建立的生态系统对健康和疾病具有深远影响,对肿瘤而言,人群中个体之间微生物组的多态性变异可能对癌症表型产生深远影响。本文总结了一些与癌症标志有关的重要组织微生物组的证据,包括肠道微生物组的多种调节作用、在其他屏障组织中发现的独特微生物组、瘤内微生物群的影响。
衰老细胞
细胞衰老是增殖停滞的典型不可逆形式,作为程序性细胞死亡的补充机制,除关闭细胞分裂周期外,还引起细胞形态和代谢变化。长期以来,细胞衰老一直被视为抗肿瘤形成的保护机制,从而诱导癌细胞衰老。但就近几年的研究而言,越来越多的证据表明,在某些情况下,衰老细胞会不同程度地刺激肿瘤发展和恶性进展,其主要机制为衰老相关分泌表型(SASP),以旁分泌方式将信号分子传递给附近的活的癌细胞以及TME中的其他细胞,以传达标志性能力。
衰老癌细胞对癌症表型影响的另一个方面涉及短暂的、可逆的衰老细胞状态,由此衰老的癌细胞可摆脱其表达SASP的非增殖状态。此外,肿瘤中的癌症相关成纤维细胞(CAF)已被证明会发生衰老,从而产生衰老的CAF,这些CAF通过向TME中的癌细胞传递标志性能力而明显促进肿瘤。
总体而言,虽然癌症标志特征已证明在癌症研究中具有持久的启发式作用,但癌症在其多样性的广度和范围上依然令人望而生畏,需更全面地理解癌症的复杂性、机制和疾病表现。其中涉及遗传学、细胞学、组织生物学、病理学等多种学科。
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144(5):646-674.
Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022;12(1):31-46.