图1 蛋白质生理功能。
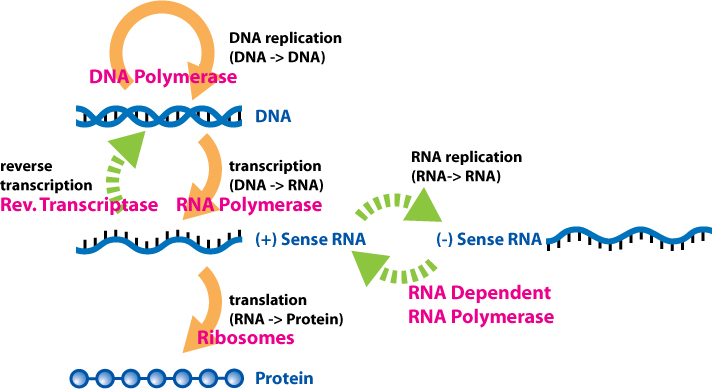
Crick于1958年提出“生物遗传中心法则”,证实生命活动调节的基础是DNA转录为RNA,RNA再翻译为蛋白质的过程。在此基础上,科研人员将目光放在了DNA与RNA上。
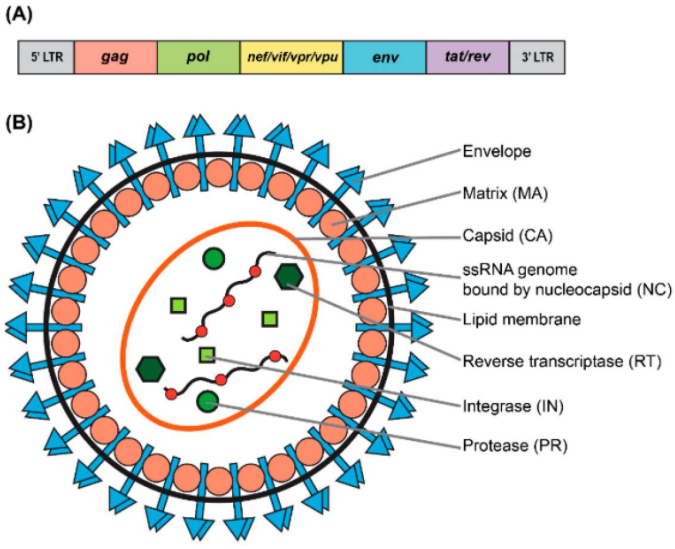
图3 慢病毒载体基因组及结构。(A)野生型人类免疫缺陷病毒1型(HIV-1)基因组的简化示意图;(B)慢病毒粒子结构(Dong W and Kantor B. 2021)。
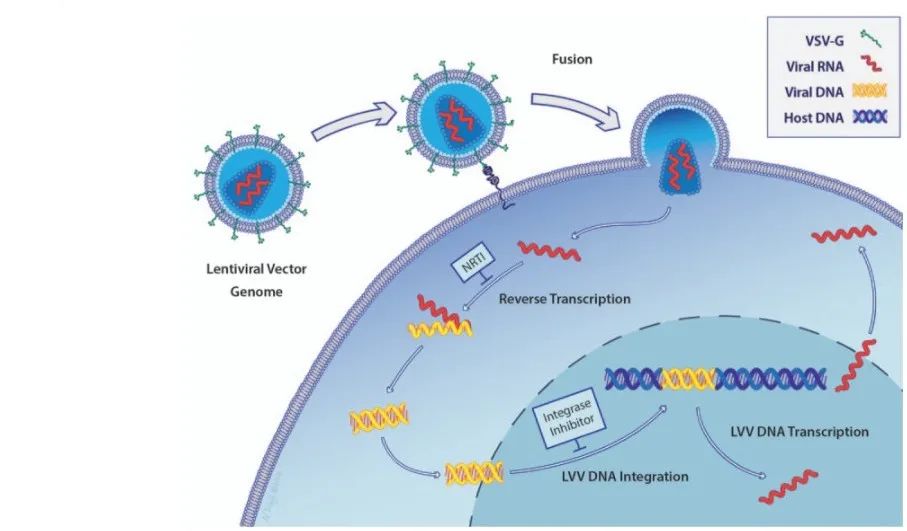
区别于一般的逆转录病毒载体,慢病毒载体对分裂细胞和非分裂细胞均具有感染能力,携带外源基因的慢病毒载体在包装质粒、细胞系的辅助下,包装成有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达(图4)。利用慢病毒载体,可研究启动子调控、过表达特定基因或沉默特定基因(RNAi)等。
1.2 产品优势
1、感染效率高:与传统质粒转染相比,LV感染无需转染试剂,且感染效率高。
2、感染谱更广:LV可高效感染神经细胞、肝细胞、心肌细胞、内皮细胞、干细胞、原代细胞等多种通常不容易转染的细胞。
3、稳定表达:相比瞬时转染,慢病毒载体可以将外源基因有效地整合到宿主染色体上,并可稳定持续表达。
1.3 我司业务范围
我司可提供丰富的LV产品体系,用于操作编码基因和非编码基因,如lncRNA、miRNA、circRNA。
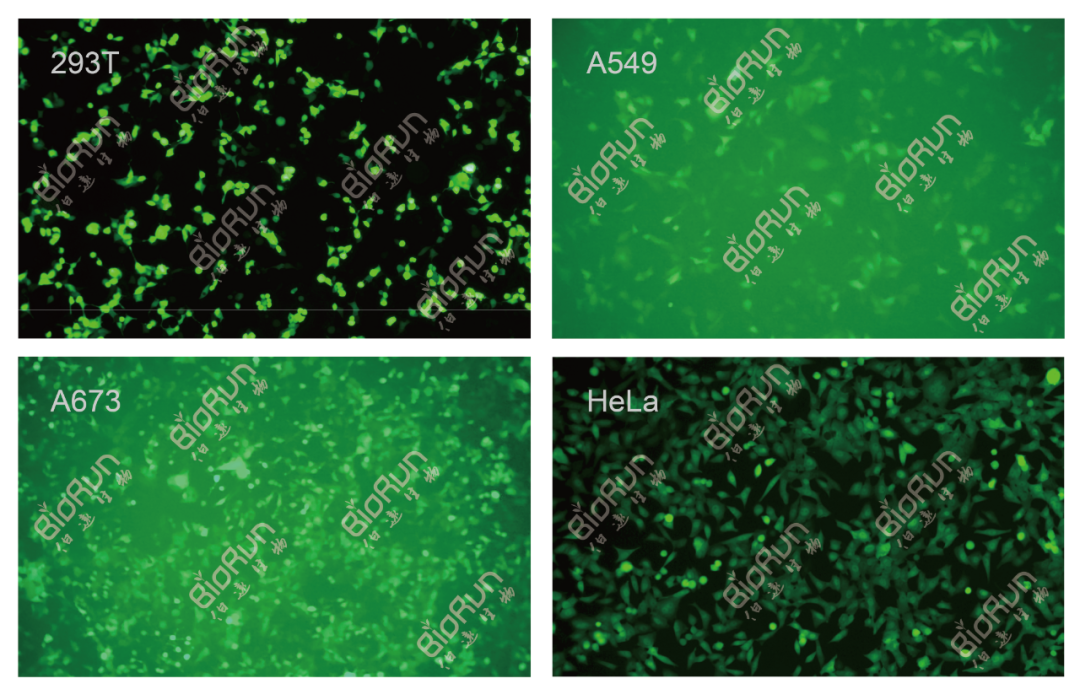
我司慢病毒载体感染宿主细胞效果良好,可满足众多科研工作者的研究需求。
图6 腺病毒衣壳的主要结构成分(Mathot F and E Bourlès. 2018)。
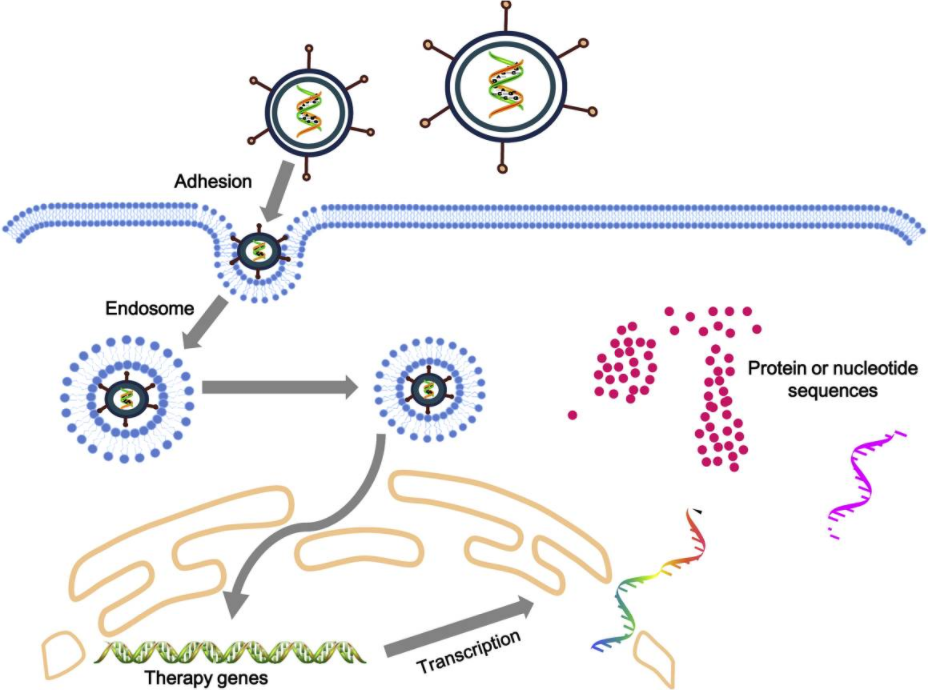
腺病毒载体(Adenoviral Vector)是以目前常用的人类腺病毒5型(基因组是一个线性的36kb dsDNA分子)为基础发展起来的基因治疗载体,其对分裂期细胞和非分裂期细胞均具有感染能力,可通过受体介导的内吞作用进入细胞内,将AV基因组转移至细胞核内,但又保持在染色体外,不整合进入宿主细胞基因组中(图7)。
图7 AV介导的基因递送至哺乳动物细胞示意图(Lee et al., 2017)。
我司目前所使用的腺病毒载体大多是E1和E3基因缺失的,感染细胞后不会在细胞体内进行复制(转有E1基因的HEK293细胞等除外),是较为安全的基因治疗载体。但该病毒仍然具有可能的潜在的生物学危险,建议不要使用编码已知或可能会致癌的基因的假型病毒,除非已经完全公认某个基因肯定没有致癌性,否则均不建议采用假型病毒进行生物学实验。
2.2 产品优势
1、宿主范围广:常用于感染难感染的细胞,不仅可感染普通细胞系,也可感染悬浮细胞、原代细胞等,以及感染增殖细胞、非增殖细胞;
2、高效:病毒滴度可高达1011PFU/mL,感染效率高;
3、载体容量大:最高可达8kb;
4、表达快:感染细胞后,1-2天即可表达;
5、有较好的生物安全性:AV携带的基因组不整合到宿主细胞的染色体中,无插入致突变性。
注:AV免疫原性高,在某些对外源刺激敏感的动物模型和组织中易造成炎症反应,体内应用需谨慎。
2.3 我司业务范围
我司采用AdMax腺病毒包装系统,将携带外源基因的腺病毒穿梭质粒(pDC316-mCMV-EGFP)与携带腺病毒大部分基因组的辅助包装质粒(pBHGlox(delta)E13Cre)共转染至HEK293细胞,然后利用Cre/loxP重组酶系统产生重组腺病毒。该系统操作简便、重组效率高、获得的病毒产率高、目的基因表达水平高。
我司腺病毒载体感染宿主细胞效果良好,可满足众多科研工作者的研究需求。
1、AV相关实验请尽量在生物安全柜(BL-2级别)内操作,需特别注意小心病毒液体溅出;
2、如操作时超净工作台面有病毒污染,请立即采用75%乙醇加1% SDS溶液擦拭,接触过病毒的枪头、离心管、培养板及培养瓶等耗材,请用84消毒液浸泡过夜后统一处理;
3、如实验过程中需离心,请使用密封性良好的离心管,或用封口膜封口后离心。
操作规范详情请参阅卫生部发布的《微生物和生物医学实验室生物安全通用准则》(WS233-2002)、美国疾病控制中心出版的《微生物和生物医学实验室生物安全(第五版)》和世界卫生组织出版的《WHO生物安全手册》。
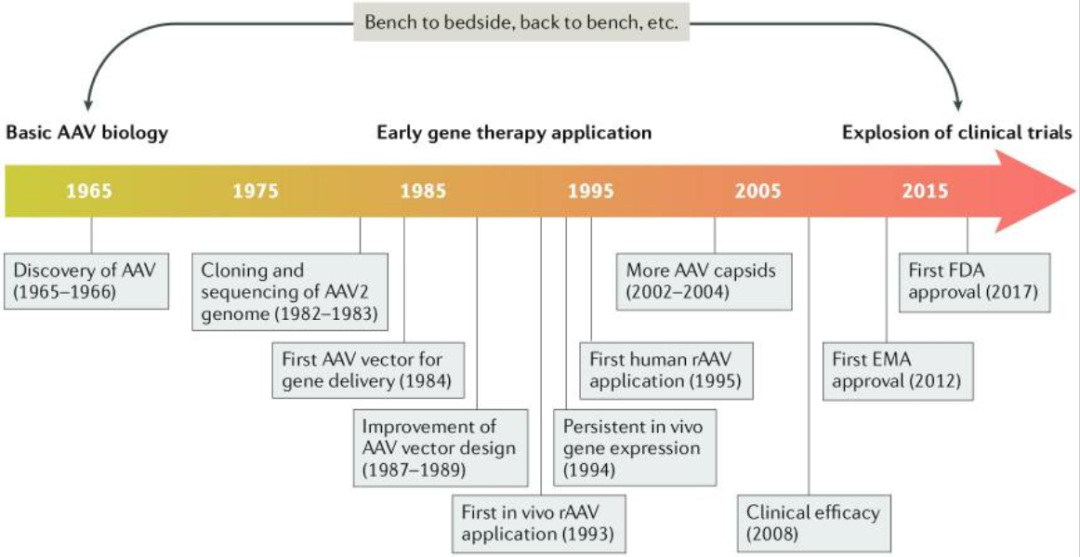
在AAV研究的前15-20年中,AAV的几个重要方面被表征,包括其基因组构型和组成、DNA复制和转录、感染潜伏期和病毒粒子组装。之后,重组AAV(rAAV)登上舞台,2012年欧洲药品管理局(EMA)批准了第一种rAAV基因治疗产品alipogene tiparvovec(Glybera)用于治疗脂蛋白脂肪酶缺乏症(uniQure公司研发);2018年,FDA又批准了voretigene neparvovec-rzyl(Luxturna),这是第一个获得美国许可的rAAV基因疗法。
图9 50年AAV时间线(Wang et al., 2019)。
AAV属微小病毒科(parvovirus),为无包膜的单链线状DNA病毒。AAV由直径约26nm的二十面体蛋白质衣壳和约4.7kb的单链DNA基因组组成,其中包括上下游两个开放阅读框,位于分别由145个核苷酸组成的2个反向末端重复序列(ITR)之间。
AAV载体需在辅助病毒(如腺病毒、单纯疱疹病毒)存在的条件下,才能在感染的宿主细胞中复制合成装配蛋白,产生新的病毒颗粒。目前,AAV载体已被广泛地应用于基础研究和临床试验中,且其已成为世界上最常用的基因治疗载体之一。
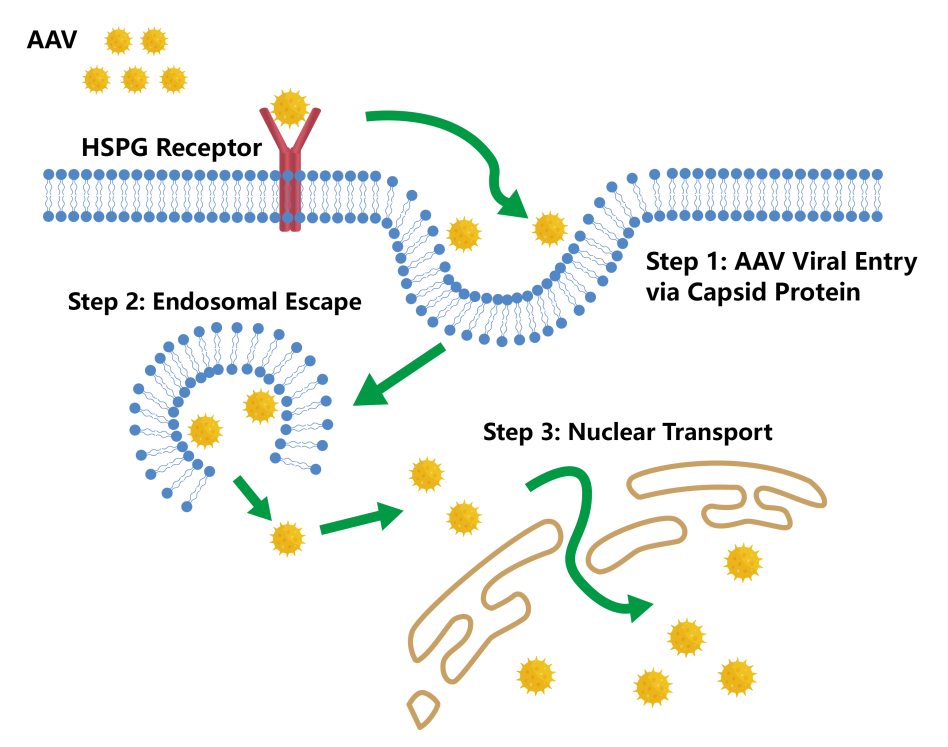
AAV2作为目前应用最广的AAV,呈现出对骨骼肌、神经元、血管平滑肌细胞和肝细胞的天然趋向性,是一种无包膜病毒粒子,基因组由单链DNA(ssDNA)组成,ssDNA被直径约20nm的球形蛋白壳包围的天然缺陷型病毒(生产性感染依赖于几个额外的反式因子),且目前尚未发现其和任何的人类疾病有关联。已知,AAV2具有三种细胞受体:硫酸乙酰肝素蛋白聚糖(HSPG)、aVβ5整合素和成纤维细胞生长因子受体1(FGFR-1)。HSPG作为主要受体发挥作用,后两个具有共受体活性,使AAV通过受体介导的内吞作用进入细胞,值得注意的是,HSPG在细胞外基质中的丰度可清除AAV颗粒并降低感染效率(图10)。
图10 AAV通过结合HSPG受体感染靶细胞示意图。
3.2 产品优势
1、安全性高、免疫原性低:目前尚无由AAV引起的人类及哺乳动物疾病报道,是FDA批准上市的基因治疗药物中最安全的病毒载体之一;
2、宿主范围广:几乎所有处于分裂期和静止期的细胞都可用AAV感染;
3、表达稳定、持续时间长:可在宿主细胞中形成附加体(episome)存在于细胞核中,体内可持续表达5个月以上;
4、物理性质稳定:在60℃不能被灭活,能抗氯仿;
5、扩散性强:AAV具有远高于AV和LV的扩散性,可穿透血脑屏障,是最理想的神经元和胶质细胞感染工具;
注:虽然AAV比AV或LV的安全性更高,且野生型AAV在人群中广泛分布,但考虑到其病毒的天然属性以及人工制备AAV的滴度比自然环境中高数个数量级,建议使用者在操作中保持一定的警惕性。
3.3 我司业务范围
目前,我司针对AAV2的载体是将AAV2的反向重复(ITR)序列和rep/cap基因分别构建至缺少共同序列的单独质粒上,这样可阻止生产出重组野生型病。AAV包装系统已明确用于调节AAV复制和表达的AV基因产物,且这些基因产物可通过转染引进宿主细胞。在该系统中,生产具感染性的AAV病毒颗粒所需的AV基因产物(如E2A、E4、VARNA)大部分由pHelper质粒提供,其余AV基因产物由稳定表达AV E1基因的AAV-293宿主细胞提供。
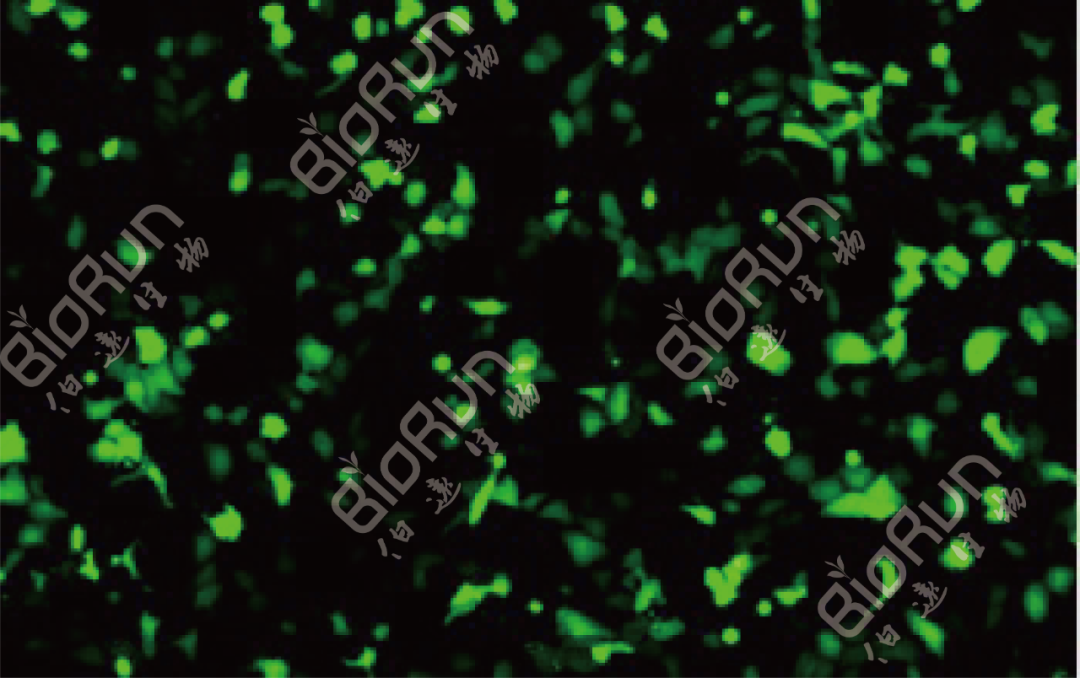
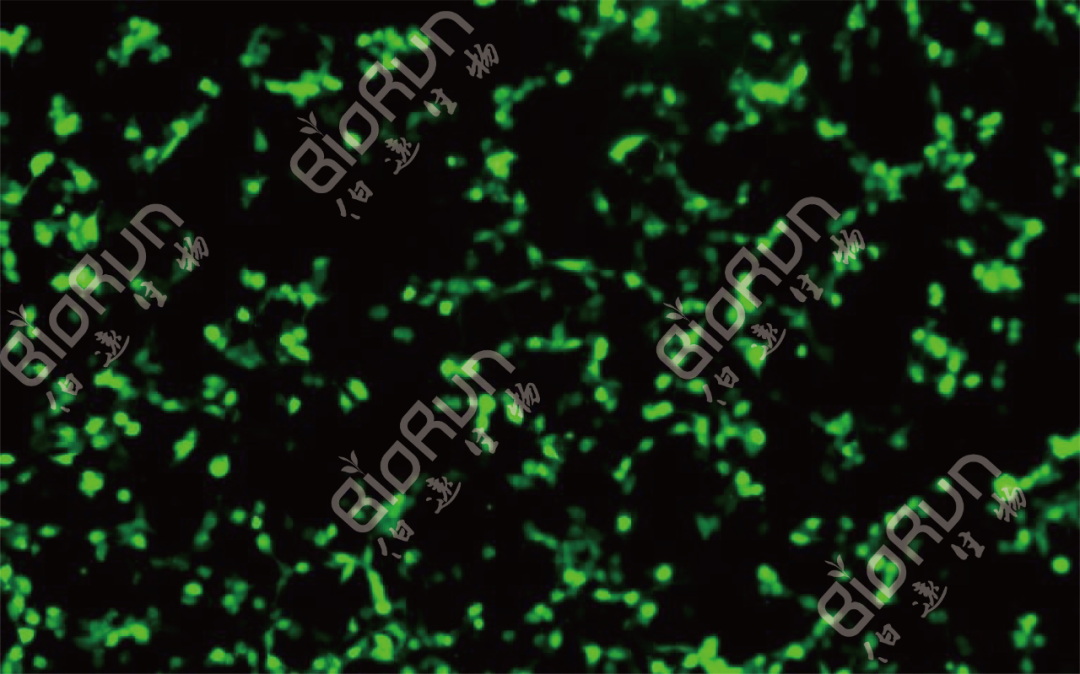
图11 我司AAV2感染的293T细胞(48h)。
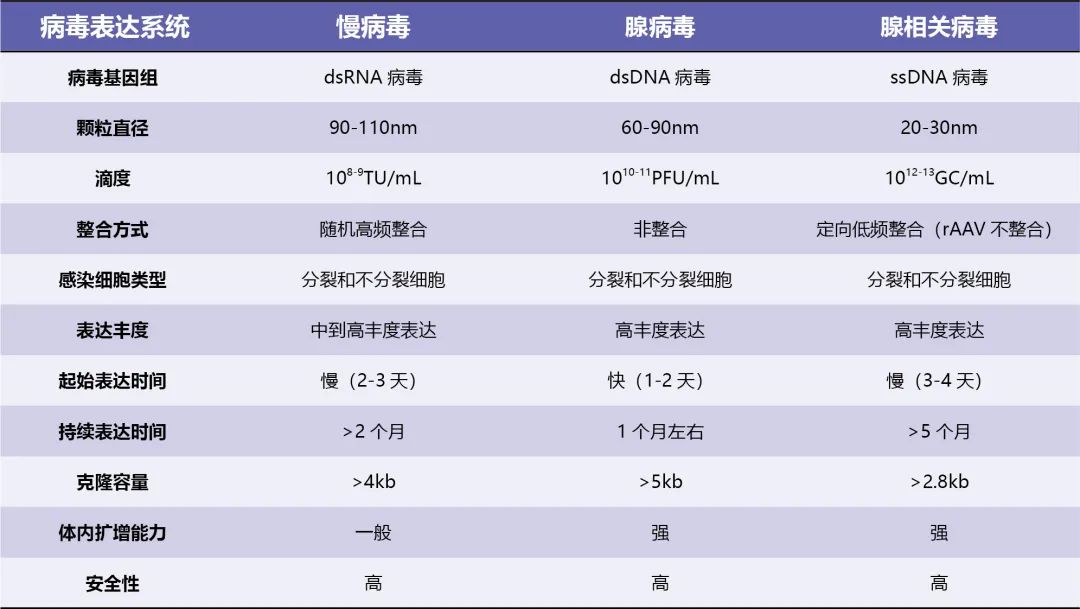
3.4 各病毒载体生物学特性比较
Lee CS, Bishop ES, Zhang R, et al. Adenovirus-Mediated Gene Delivery: Potential Applications for Gene and Cell-Based Therapies in the New Era of Personalized Medicine. Genes Dis. 2017;4(2):43-63.
Mathot F, E Bourlès. Development of a Freeze-Dried Ebola-Expressing Adenoviral Vector Unexpected Findings and Problems Solved. BioProcess International Conference and Exhibition September 2017. 2018.
Schlimgen R, Howard J, Wooley D, et al. Risks Associated With Lentiviral Vector Exposures and Prevention Strategies. J Occup Environ Med. 2016;58(12):1159-1166.
Wang D, Tai PWL, Gao G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 2019;18(5):358-378.