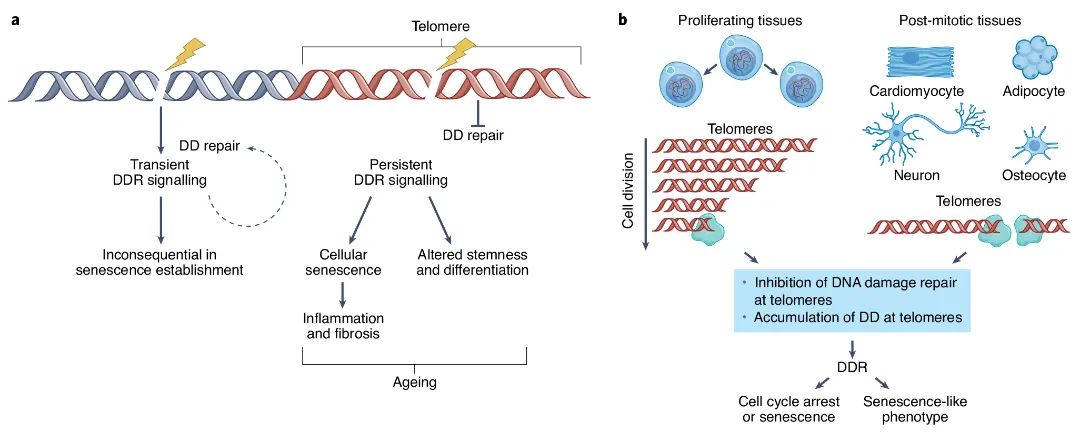
端粒作为线性染色体末端组成成分,可随DNA复制逐渐缩短,当端粒长度达到临界值时,DNA损伤反应(DDR)通路被激活,进而阻止细胞增殖,最终,细胞衰老被启动与维持,即长端粒DNA损伤会在机体衰老的时间范围内导致端粒末端部分的降解或丢失,从而导致端粒缩短,这就是导致机体衰老和多种与年龄相关疾病的关键因素(图1)。端粒功能障碍后,某些细胞也可能因细胞凋亡或自噬而发生细胞死亡。
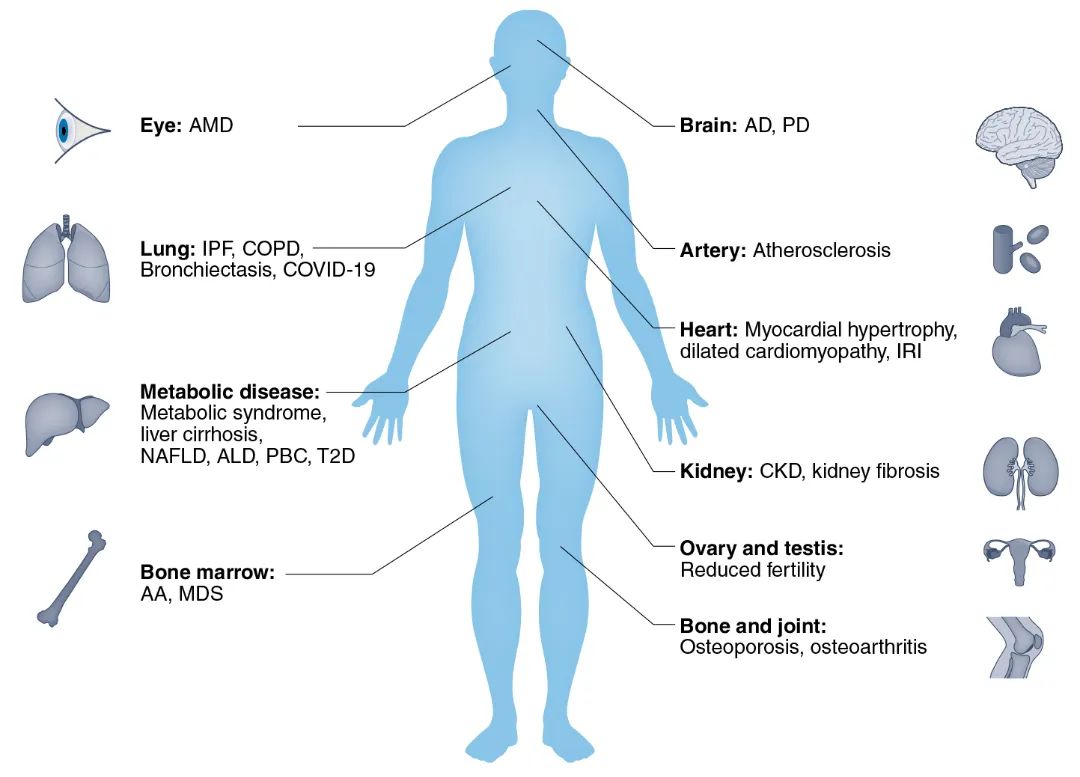
特发性肺纤维化(IPF)影响全球约300万人,是一种以间质重塑为特征的肺退行性疾病,人类衰老肺部的纤维化与端粒缩短、DDR和细胞衰老有关。
研究指出,IPF患者在肺部积聚TAF和衰老标志物,随着疾病的严重程度增加并激活衰老相关分泌表型(SASP)。在“Cellular senescence and senescence-associated secretory phenotype: comparison of idiopathic pulmonary fibrosis, connective tissue disease-associated interstitial lung disease, and chronic obstructive pulmonary disease”一文中,作者就表明细胞衰老和SASP在肺纤维化疾病中比在肺气肿疾病中更明显。同年“Loss of PTEN induces lung fibrosis via alveolar epithelial cell senescence depending on NF‐κB activation”一文的研究结果指出,作为IPF的第一步,肺泡上皮细胞(AEC)的衰老过程可能是一个潜在治疗靶点,而PTEN/NF-κB信号通路可能是一个有希望的干预候选者。
不仅如此,介于间质性肺异常(ILA)与IPF之间的许多共同特征,最新研究指出,ILA亦与平均端粒长度缩短有关(Putman et al. 2022)。
慢性阻塞性肺疾病
据医学权威杂志《柳叶刀》介绍,慢性阻塞性肺病(COPD)影响着全球约3亿人,并与老年患者的高发病率和死亡率相关。研究指出,与正常人群相比,COPD患者的小气道上皮细胞显示出更高水平的TAF和衰老标志物,并且在COPD患者的肺和循环白细胞中可观察到短端粒,证实端粒酶突变是COPD患者发生肺气肿的危险因素。
肿瘤
研究显示,不受限制的端粒缩短是肿瘤发展过程中的主要障碍,而端粒维持的抑制为靶向癌症治疗提供了很大程度上尚未开发的机会。在“Integrated evaluation of telomerase activation and telomere maintenance across cancer cell lines”一文中,作者采用来自CCLE和GDSC数据库中收录的基因组序列,计算了1299个癌细胞系的端粒含量,发现端粒酶逆转录酶(TERT)表达与肺、中枢神经系统和白血病细胞系中的端粒含量相关。同时,该研究的结果表明,细胞系端粒含量确实随组织类型、TERT mRNA表达以及DAXX和VHL等基因突变等因素而变化。此项研究为将端粒研究作为肿瘤治疗新方向提供了新的理论基础与见解。
其他肺部疾病
据预测,由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的2019年冠状病毒病(COVID-19)会导致长期肺纤维化。疾病严重程度与患者年龄和白细胞端粒长度相关,这与最近的发现一致,即端粒缩短诱导的tDDR激活会增加人肺细胞上SARS-CoV-2受体ACE2的表达。
Hu K, Ghandi M, Huang FW. Integrated evaluation of telomerase activation and telomere maintenance across cancer cell lines. Elife. 2021;10:e66198.
Okuda R, Aoshiba K, Matsushima H, et al. Cellular senescence and senescence-associated secretory phenotype: comparison of idiopathic pulmonary fibrosis, connective tissue disease-associated interstitial lung disease, and chronic obstructive pulmonary disease. J Thorac Dis. 2019;11(3):857-864.
Putman RK, Axelsson GT, Ash SY, et al. Interstitial lung abnormalities are associated with decreased mean telomere length. Eur Respir J. 2022;2101814.
Rossiello F, Jurk D, Passos JF, et al. Telomere dysfunction in ageing and age-related diseases. Nat Cell Biol. 2022;24(2):135-147.
Tian Y, Li H, Qiu T, et al. Loss of PTEN induces lung fibrosis via alveolar epithelial cell senescence depending on NF-κB activation. Aging Cell. 2019;18(1):e12858.