自然杀伤(Natural killer, NK)细胞是具有高度细胞毒性的免疫效应细胞,由Herberman在1976年定义(Herberman et al., 1976)。NK细胞天生就能够识别应激细胞,例如肿瘤细胞和某些感染细胞,并介导肿瘤细胞的自发杀伤,即以非特异性方式杀死其靶标,因此被称为“自然”杀手(Rezvani et al., 2017)。
考虑到NK细胞在恶性肿瘤生物学中的关键作用,它们自然而然地成为恶性肿瘤治疗的潜在靶点,越来越多的研究和多种治疗剂抑制恶性肿瘤靶向NK细胞相关通路。下面就和小医一起来学习一下NK细胞在肿瘤免疫中的作用及在免疫治疗中的应用吧!
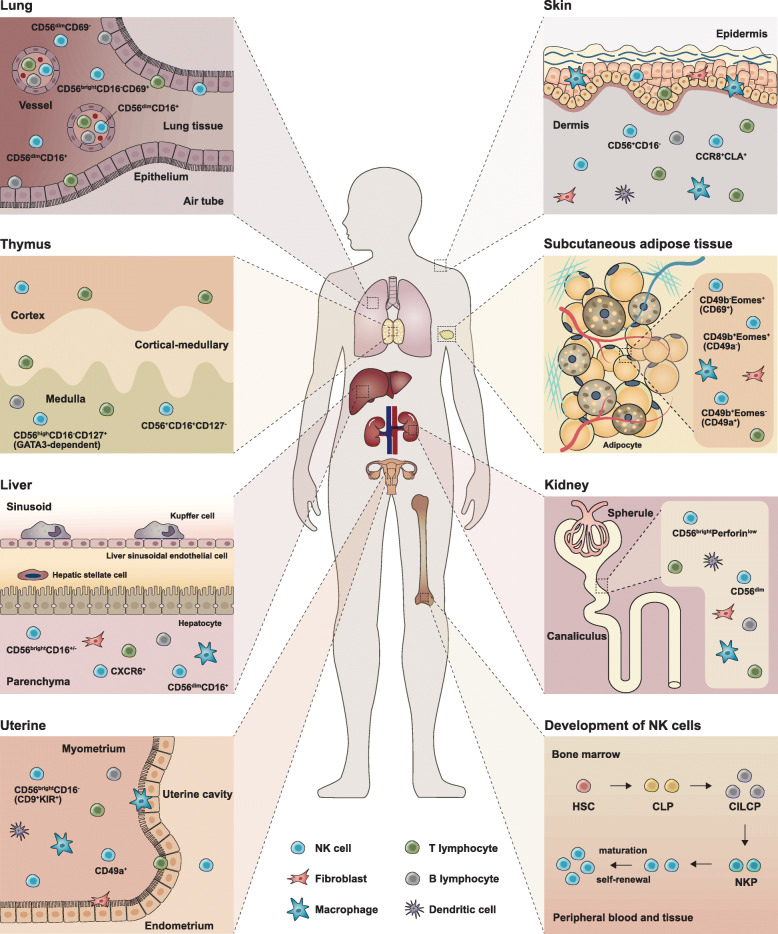
图1 NK细胞的发育和亚群(Wu et al., 2020)。
据了解,NK细胞占人体循环淋巴细胞的5-20%,识别NK细胞的一个关键特征是这些细胞可被MHC-Ⅰ分子受体抑制。已有充分的证据表明Lin−CD34+造血干细胞(HSC)分化为CD45RA+淋巴引发的多能祖细胞(LMPP),通过表达CD38、CD7、CD10和细胞因子受体CD127,LMPP转变为常见的淋巴祖细胞(CLP),这些细胞有可能将谱系定型为Pro-B、Pre-T、NK细胞祖细胞(NKP)或其他先天性淋巴细胞(图2)。
图2 人类NK细胞的发育与起源(Abel et al., 2018)。
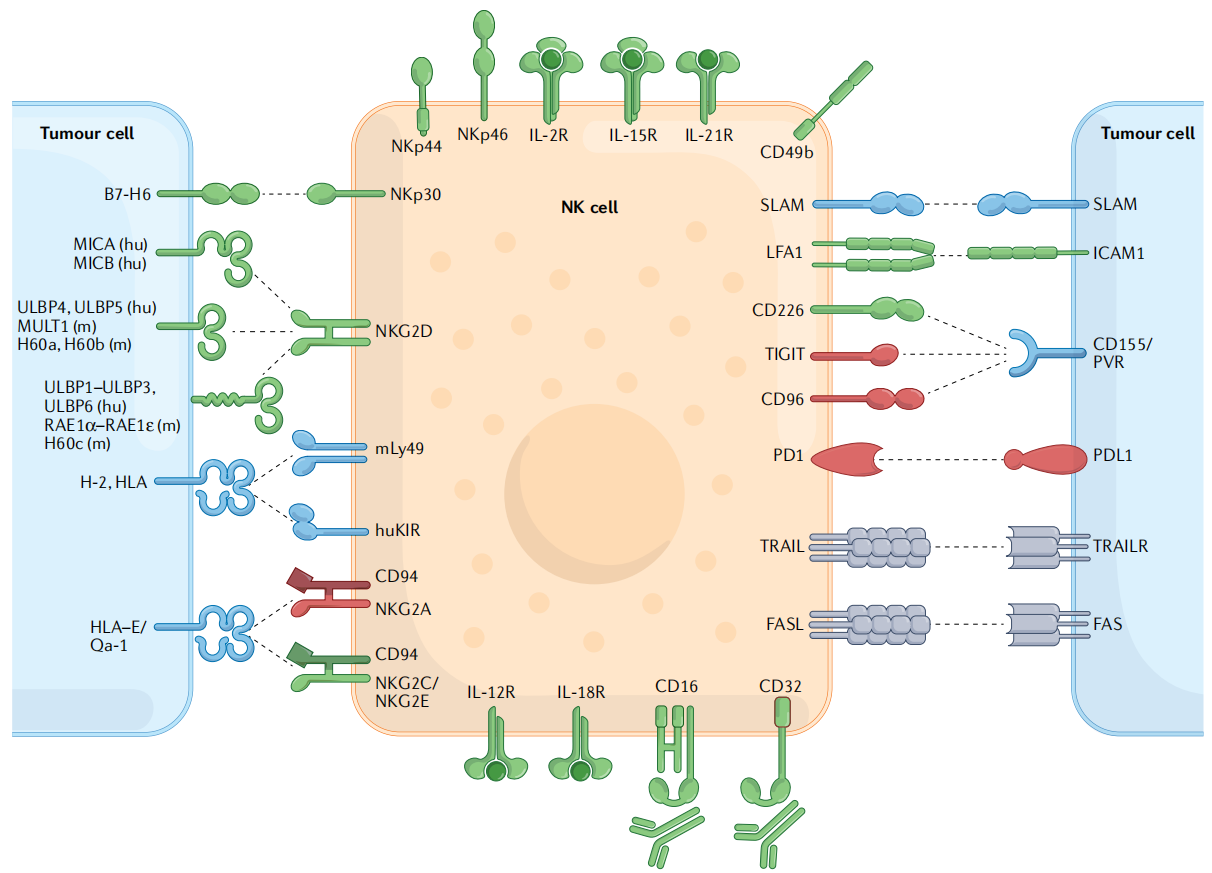
CD122的表达标志着CLP进入NK谱系的不可逆进程;CD56的出现表明未成熟NK细胞最终转变为成熟NK细胞。成熟的NK细胞通过种系编码的激活和抑制受体系统识别其靶细胞,这些受体可识别潜在靶细胞上的膜结合配体(图3)。
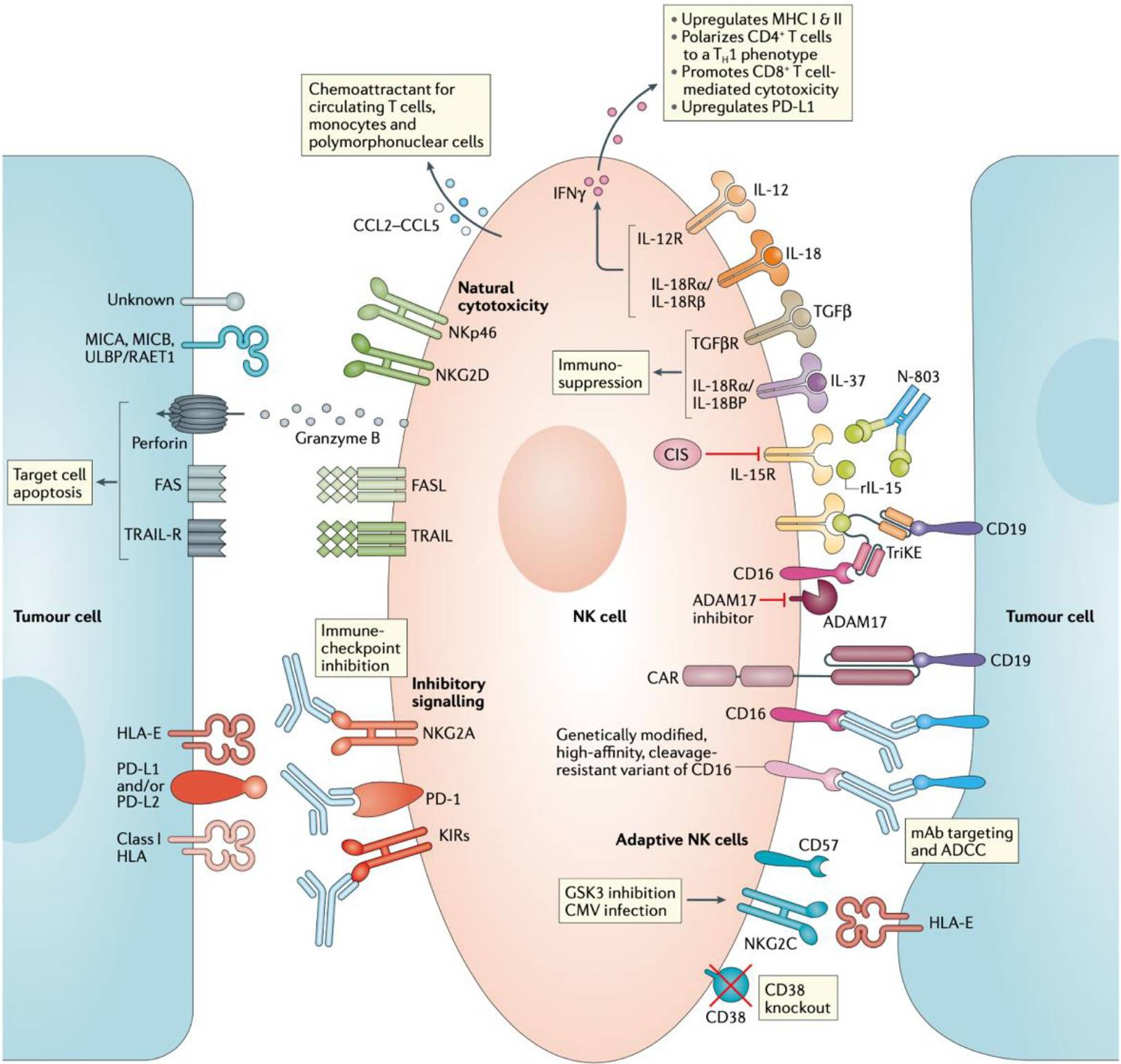
研究表明,在小鼠肿瘤模型中,产生IFNγ的NK细胞对肿瘤的早期浸润与TME的重塑和释放的细胞毒性T淋巴细胞介导的肿瘤根除有关(Bonavita et al., 2020)。近年来的大量数据证实,TME的特性,包括PGE2(一种在各种恶性肿瘤中上调的小分子),可降低NK细胞的细胞毒性;存在于TME中的各种细胞类型(成纤维细胞、基质细胞、调节性T细胞(Tregs)、髓源性抑制细胞(MDSC))可以下调免疫反应(Cózar et al., 2021)。下图总结了增强NK细胞效应功能的各种方法。
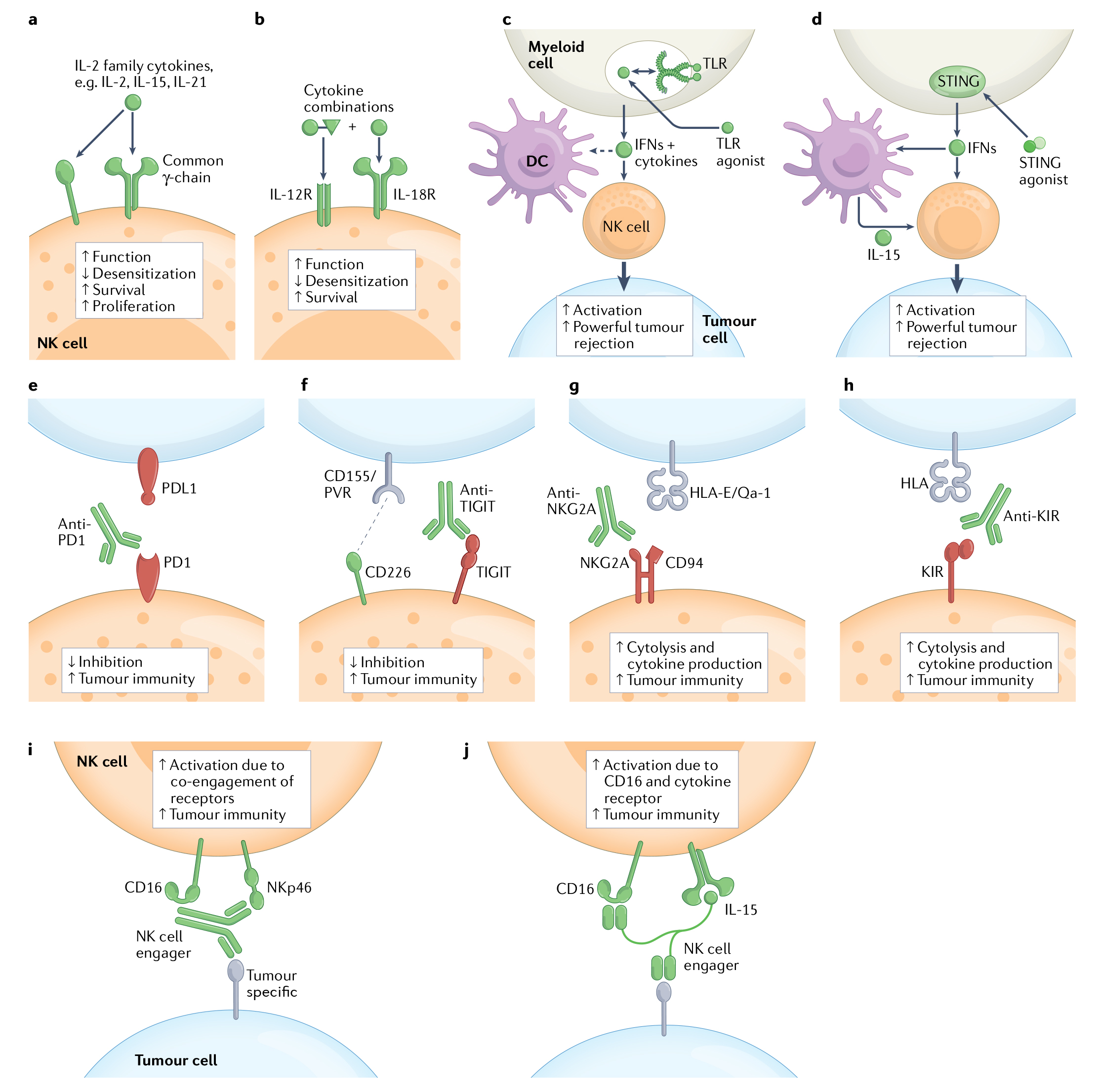
据报道,IL-2(最初被描述为T细胞生长因子)可刺激NK细胞的活化和增殖,近年来,为优化IL-2作为免疫治疗剂的疗效,科研人员对IL-2进行了修饰或工程化处理,其中,一种方法是延长IL-2体内半衰期,可通过将细胞因子与抗体的白蛋白或Fc结构域融合,或通过将聚乙二醇与分子缀合来实现;另一种方法是对分子进行工程改造,以改变其与IL-2受体成分的结合(图5a)。
之后,出现的IL-15疗法已经成为IL-2疗法的一种有希望的替代疗法,其可与与IL-15Rα链结合后,与IL-2Rβ具有高亲和力。随后,研究又发现,IL-12与IL-18可有效增强NK细胞(和T细胞)的功能活性,可有效刺激体外NK细胞的IFNγ产生,并在体内维持了带有某些肿瘤的小鼠的生存(图5b)。
在药物研发中,TLR激动剂、STING激动剂等作为免疫治疗药物正获得越来越多的信任,因为它们被称为诱导强大的先天和适应性免疫反应(图5c、d)。众所周知,PD1和PDL1免疫检查点阻断疗法的成功主要是在放大T细胞反应的背景下解释的,但近期有研究指出,在某些恶性肿瘤中,NK细胞也会上调抑制性受体PD1,并且在某些情况下,PD1参与可以抑制NK细胞(图5e)。
再者,TIGIT(一种抑制性受体)在T细胞和NK细胞上都有表达,已经被证明可通过与抗原提呈细胞或肿瘤细胞上的配体CD155相互作用抑制两种类型的淋巴细胞(图5f)。
此外,Monalizumab是一种人源化抗NKG2A单克隆抗体,可阻断NKG2A,在靶细胞表达HLA-E时释放NK细胞和T细胞功能(图5g);针对抑制性受体KIR2DL1、KIR2DL2和KIR2DL3特异的抗KIR抗体在多种肿瘤模型中增强了针对恶性细胞的NK细胞功能(图5h)。
最后,还可通过产生“NK细胞接合剂”来增强NK细胞对肿瘤的功能,该接合剂由连接NK细胞激活受体和肿瘤细胞特异性分子的双特异性或三特异性抗体组成(图5i、j)。这种方法在概念上类似于T细胞接合器,它是连接细胞毒性T细胞到肿瘤细胞的桥梁。
图5 调动NK细胞抗肿瘤反应的免疫治疗方法总结示意图(Wolf et al., 2022)。
Bonavita E, Bromley CP, Jonsson G, et al. Antagonistic Inflammatory Phenotypes Dictate Tumor Fate and Response to Immune Checkpoint Blockade. Immunity. 2020;53(6):1215-1229.e8.
Cózar B, Greppi M, Carpentier S, et al. Tumor-Infiltrating Natural Killer Cells. Cancer Discov. 2021;11(1):34-44.
Herberman RB, Holden HT, Ting CC, et al. Cell-mediated immunity to leukemia virus- and tumor-associated antigens in mice. Cancer Res. 1976;36(2 pt 2):615-621.
Hinshaw DC, Shevde LA. The Tumor Microenvironment Innately Modulates Cancer Progression. Cancer Res. 2019;79(18):4557-4566.
Myers JA, Miller JS. Exploring the NK cell platform for cancer immunotherapy. Nat Rev Clin Oncol. 2021;18(2):85-100.
Rezvani K, Rouce R, Liu E, et al. Engineering Natural Killer Cells for Cancer Immunotherapy. Mol Ther. 2017;25(8):1769-1781.
Wolf NK, Kissiov DU, Raulet DH. Roles of natural killer cells in immunity to cancer, and applications to immunotherapy. Nat Rev Immunol. 2022;10.1038/s41577-022-00732-1.
Wu SY, Fu T, Jiang YZ, et al. Natural killer cells in cancer biology and therapy. Mol Cancer. 2020;19(1):120.