最新细胞功能及机制文献分享
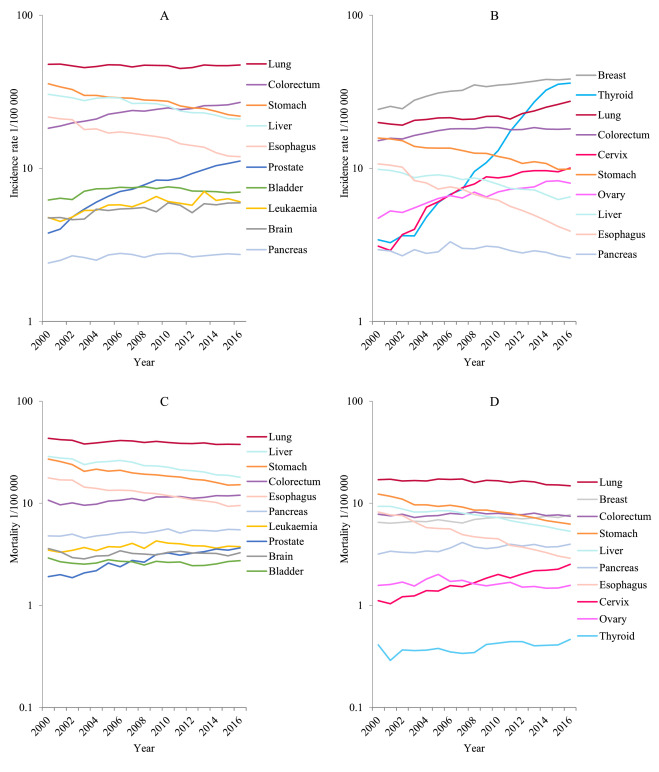
图1 2000年至2016年中国按性别分列的特定癌症的发病率和死亡率趋势(Zheng et al., 2022)。(A)男性发病率;(B)女性发病率;(C)男性死亡率;(D)女性死亡率。
环状RNA(circRNA)由前体mRNA反向剪接产生,被认为是基因表达的重要调节因子。随着高通量测序和生物信息学的发展,circRNA越来越被认为是各种生物过程的主要调节剂和人类健康以及疾病的关键参与者,特别是,已证明circRNA在恶性肿瘤生长、转移、复发和治疗抵抗中发挥重要作用(Guarnerio et al., 2016)。
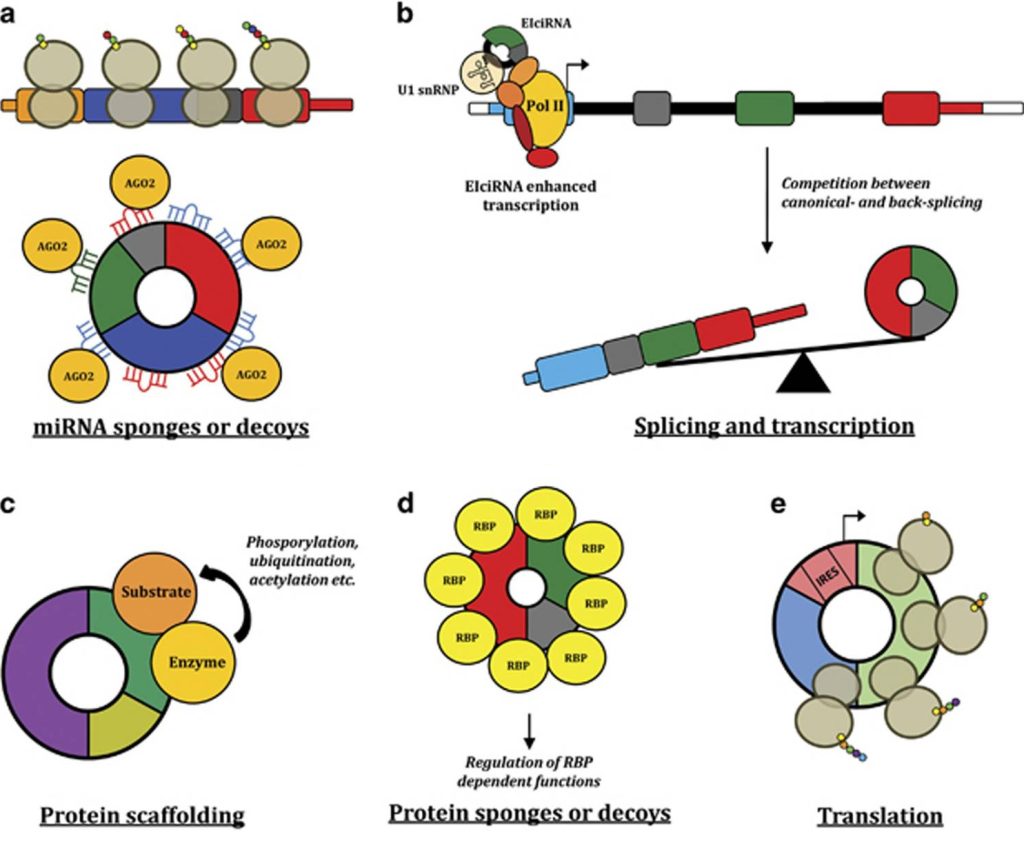
详细而言,circRNA在恶性肿瘤中具有以下功能:
1)许多circRNA可能充当miRNA海绵或诱饵,发挥ceRNA机制功能(图2a);
2)已有研究显示外显子-内含子circRNA与RNA polⅡ相关,并通过与U1 snRNP的相互作用增强其亲本基因的转录,且许多基因的剪接和转录也可通过典型剪接和反向剪接之间的竞争来间接调节(图2b);
3)具有酶及其底物结合基序的circRNA可作为支架发挥作用,促进共定位和反应动力学(图2c);
4)具有RNA结合蛋白结合基序的circRNA可作为蛋白质的海绵或诱饵,从而调节它们的活性(图2d);
5)在某些情况下,带有IRES元件和AUG位点的circRNA可用作翻译模板(图2e)。
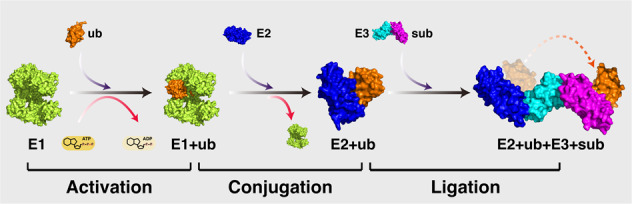
图3 泛素化过程示意图(Dang et al., 2021)。泛素化包括三个主要步骤:(1)激活步骤——泛素蛋白通过E1介导的泛素蛋白C端酰基腺苷酸化催化活化,在ATP提供能量的情况下将泛素转移到活性半胱氨酸残基上;(2)缀合步骤——E2泛素结合酶催化泛素从E1转移到E2的活性位点半胱氨酸;(3)连接步骤——E3泛素连接酶将底物(sub)和载有泛素的E2结合在一起,催化泛素从E2转移到底物上。
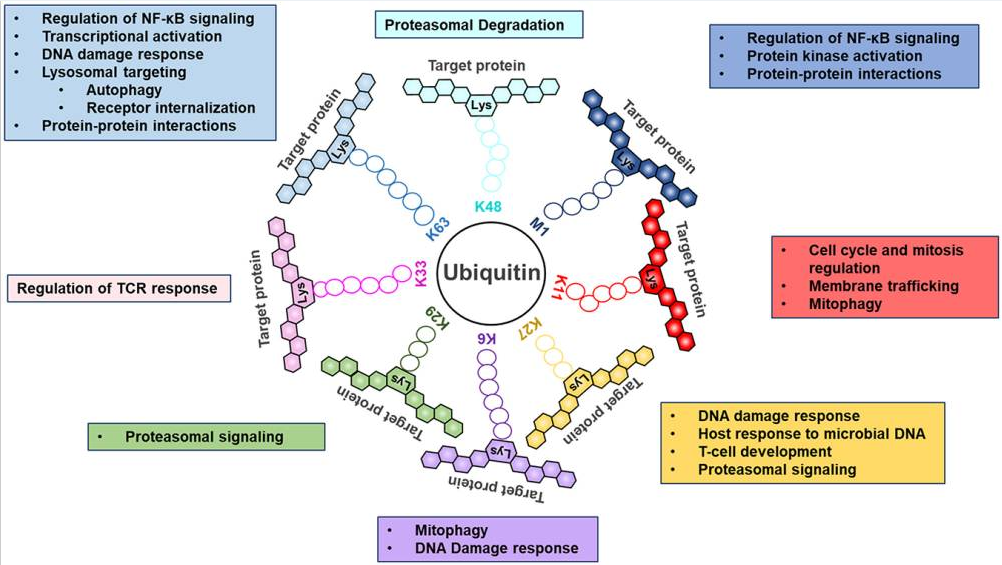
最初,泛素系统因其在蛋白酶体降解中的作用而被认可,而最近发现了其他调节功能,包括调节线粒体自噬、受体内化和下调、细胞内运输、DNA修复和蛋白质-蛋白质相互作用(图4)。换句话说,通可过泛素化处理蛋白质决定细胞命运,包括衰老、自噬或细胞死亡,并控制细胞增殖和分化。
越来越多的证据表明,失调的E3泛素连接酶在人类恶性肿瘤的发生发展以及治疗反应中起着至关重要的作用,可作为抗肿瘤药物的有希望的治疗靶点。根据它们泛素化和降解的底物,E3泛素连接酶本身可以发挥促肿瘤或抑肿瘤的作用(Qi J, Ronai ZA. 2015)。
研究前期,团队从南通肿瘤医院获得了2018年4月至2020年9月的103对GC患者肿瘤及邻近非肿瘤组织、120份GC患者血清样本、50份胃炎患者血清样本以及120份健康供体血清样本。之后,团队通过分析GEO数据集确定了GC中差异表达的circRNA。
正式实验上,团队构建了circEIF4G3敲低与过表达的细胞模型,通过体外功能实验(RNA-FISH、细胞增殖与迁移和侵袭检测、细胞凋亡检测)以及体内动物实验(免疫组织化学法(IHC)、苏木精和伊红(H&E)染色、裸鼠皮下异种移植肿瘤模型)结合qRT-PCR、Western blot研究探索了circRNA在GC中的生物学作用;机制上,团队进行了标记RNA亲和纯化(TRAP)、RNA免疫沉淀(RIP)、免疫共沉淀(Co-IP)、质谱分析(MS)、液相色谱串联质谱(LC-MS/MS)、RNA测序、双荧光素酶报告基因分析以及拯救实验,并结合相关生物信息学分析以研究GC中circRNA的分子作用机制。同时,评估了circEIF4G3表达水平与患者病理参数之间的关联。
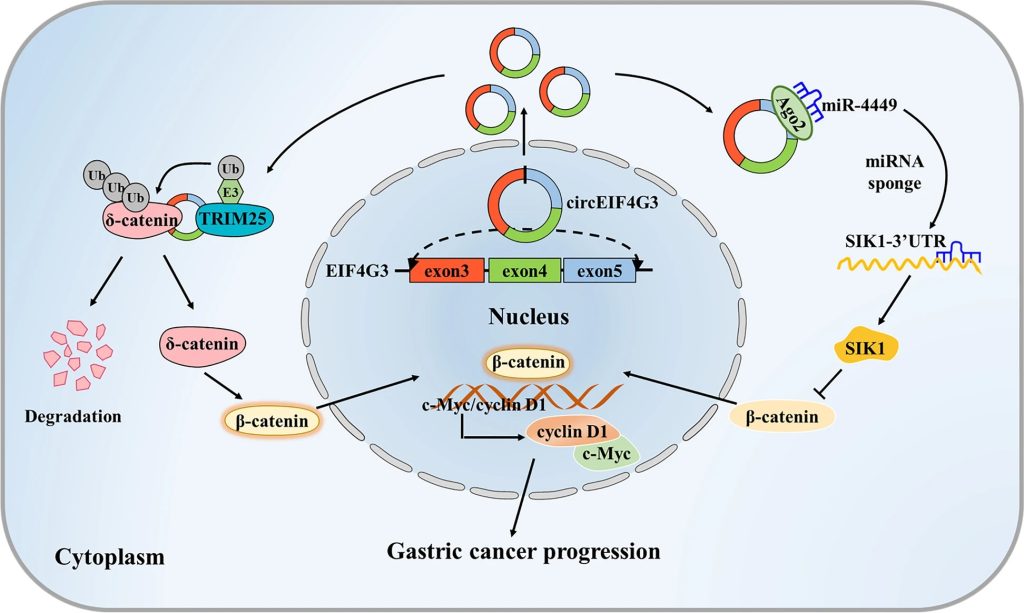
团队揭示了一种新的circRNA即circEIF4G3在GC进展中的作用,并阐明了其作用机制(图5)。具体如下,GC患者中CircEIF4G3表达下调,预示预后不良,其通过形成circEIF4G3/δ-catenin/TRIM25 RNA-蛋白质三元复合物使δ-catenin不稳定,从而增强TRIM25介导的δ-catenin泛素化和蛋白酶体降解;circEIF4G3还可发挥ceRNA机制功能从而促进SIK1表达,双重调节导致β-连环蛋白信号失活并抑制GC的发生发展。综上,团队的研究结果为GC预后提供了一个有希望的生物标志物和GC治疗的潜在靶点。
Guarnerio J, Bezzi M, Jeong JC, et al. Oncogenic Role of Fusion-circRNAs Derived from Cancer-Associated Chromosomal Translocations. Cell. 2016; 166(4):1055-1056.
Kristensen LS, Hansen TB, Venø MT, et al. Circular RNAs in cancer: opportunities and challenges in the field. Oncogene. 2018;37(5):555-565.
Mooney EC, Sahingur SE. The Ubiquitin System and A20: Implications in Health and Disease. J Dent Res. 2021;100(1):10-20.
Qi J, Ronai ZA. Dysregulation of ubiquitin ligases in cancer. Drug Resist Updat. 2015;23:1-11.
Zang X, Jiang J, Gu J, et al. Circular RNA EIF4G3 suppresses gastric cancer progression through inhibition of β-catenin by promoting δ-catenin ubiquitin degradation and upregulating SIK1. Mol Cancer. 2022;21(1):141.
Zheng R, Zhang S, Zeng H, et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Cent. 2022; 2(1):1-9.