编者按:
至今,已发现多种不同类型的程序性细胞死亡(如细胞凋亡,细胞焦亡和细胞坏死等等),它们在形态学、生理学和生物化学方面不同。铁死亡(Ferroptosis)是一种铁依赖性的脂质过氧化、ROS过量产生所致的新型细胞死亡类型。铁死亡可见于放疗、化疗和肿瘤免疫治疗,在癌症治疗中具有巨大潜力。本文将重点阐述细胞程序性死亡的新型形式-铁死亡在癌症和癌症免疫治疗中所扮演的角色及应用。本文首先探讨了铁死亡与其他常见细胞程序性死亡异同点;其次概述了铁死亡的发生过程及其相关代谢途径;着重描述了铁死亡与癌症中经典细胞信号通路之间的“交叉对话”,以及铁死亡在抗肿瘤治疗和肿瘤免疫治疗中所扮演的角色及其应用。最后,本综述展望了靶向诱导肿瘤铁死亡及联合其他治疗方法可能是克服传统癌症治疗耐药机制的潜在策略。
近几年,程序性细胞死亡(细胞焦亡、铁死亡、铜死亡……)的热度居高不下,一轮接着一轮火热起来!那是为什么呢?今天我们先来看看最近火起来的“铁死亡”,看完就明白为什么了!
铁死亡(Ferroptosis)是一种新发现的依赖于脂质过氧化的细胞死亡类型,在形态学、生理学和生物化学方面不同于经典的程序性细胞死亡。铁死亡可见于放疗、化疗和肿瘤免疫治疗,在癌症治疗中的具有巨大潜力。当前,铁死亡已经成为肿瘤研究领域的热点。2022年2月8日浙江大学生命科学研究所的张龙等发表于Cancer Communications上的综述,详细解读了铁死亡中脂质过氧化导致细胞死亡的特征和原因,总结了铁死亡的三大代谢规律及其与经典信号通路。下面就让我们来跟随这篇文章全面了解一下癌症和癌症免疫治疗中的铁死亡。
各种类型的程序性细胞死亡特征
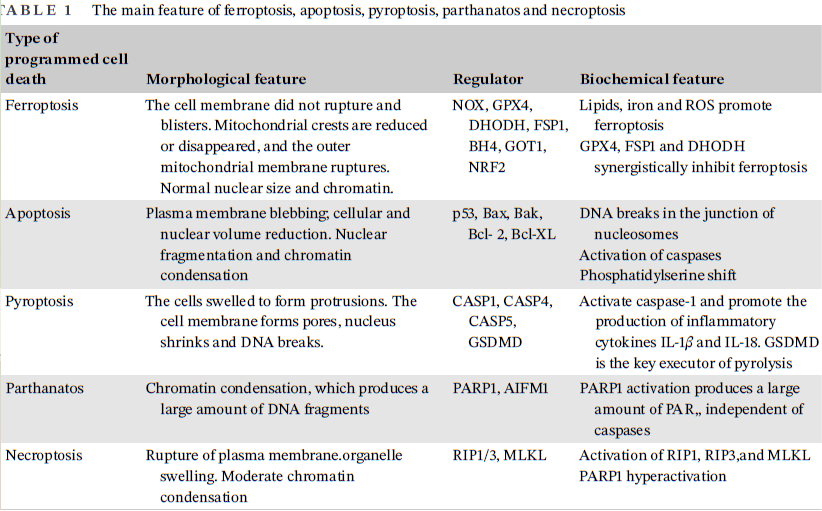
程序性细胞死亡(PCD)是胚胎发生、组织稳态、免疫反应和其他过程的基础,对于正常发育、稳态和预防癌症等过度增殖性疾病至关重要。目前,已经确定了各种类型的程序性细胞死亡,例如细胞凋亡、细胞焦亡、parthanatos、坏死性凋亡和铁死亡。铁死亡和已知的细胞死亡具有不同的表型特征、生化特征和调控因子(见下表)。
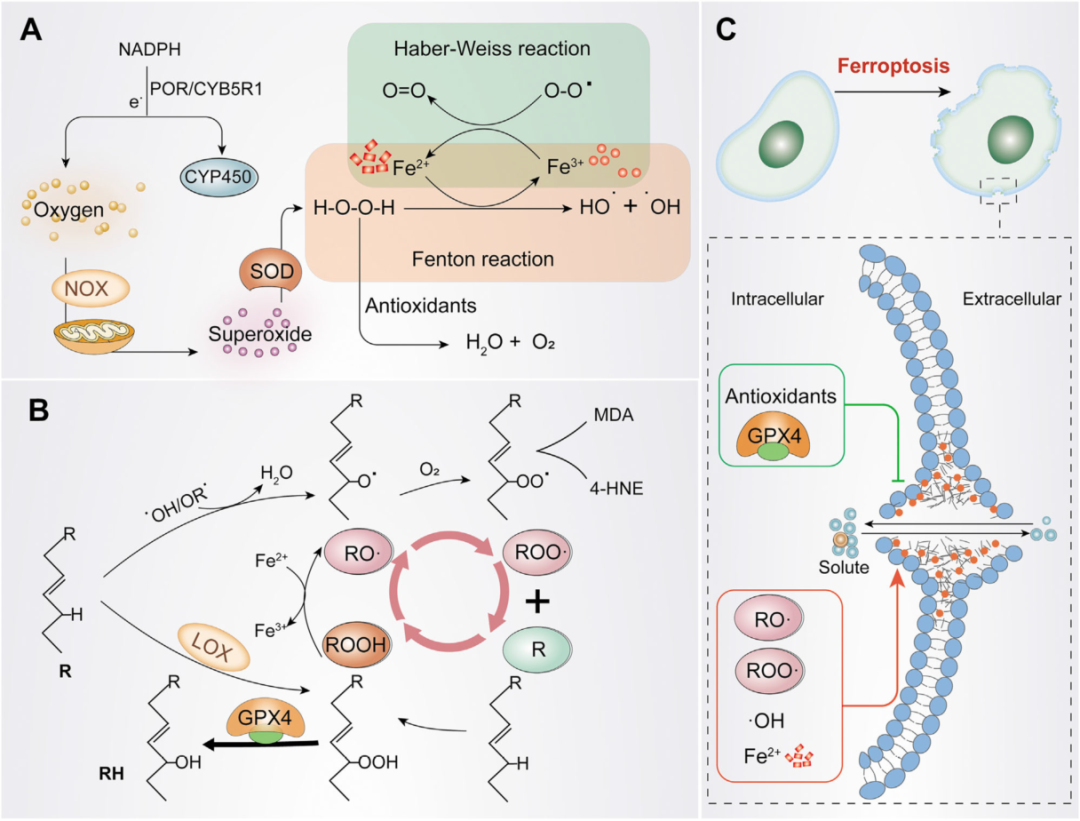
铁死亡的发生
A)OH·和O2·的生成。氧气在NADPH或NOX和线粒体的作用下产生O2·。随后,O2·在 SOD的作用下转化为H2O2。H2O2在铁离子存在下形成 H2O·,使多不饱和脂肪酸(PUFA)失去氢原子,导致脂质过氧化。
B)脂质过氧化循环及其终止。HO·或RO·催化R形成RO·,RO·与氧气快速反应形成ROO·,然后从另一个R中提取氢气产生新的RO·和ROOH(正反馈链式反应)。GPX4可用作抗氧化剂将ROOH还原为R以停止过氧化反应。
C)发生铁死亡。ROO·分解产生MDA和4-HNE,然后与蛋白质、DNA、脂类等大分子形成共价加合物,交联和失活促进铁死亡的蛋白质,从而促进细胞膜破裂和铁死亡。
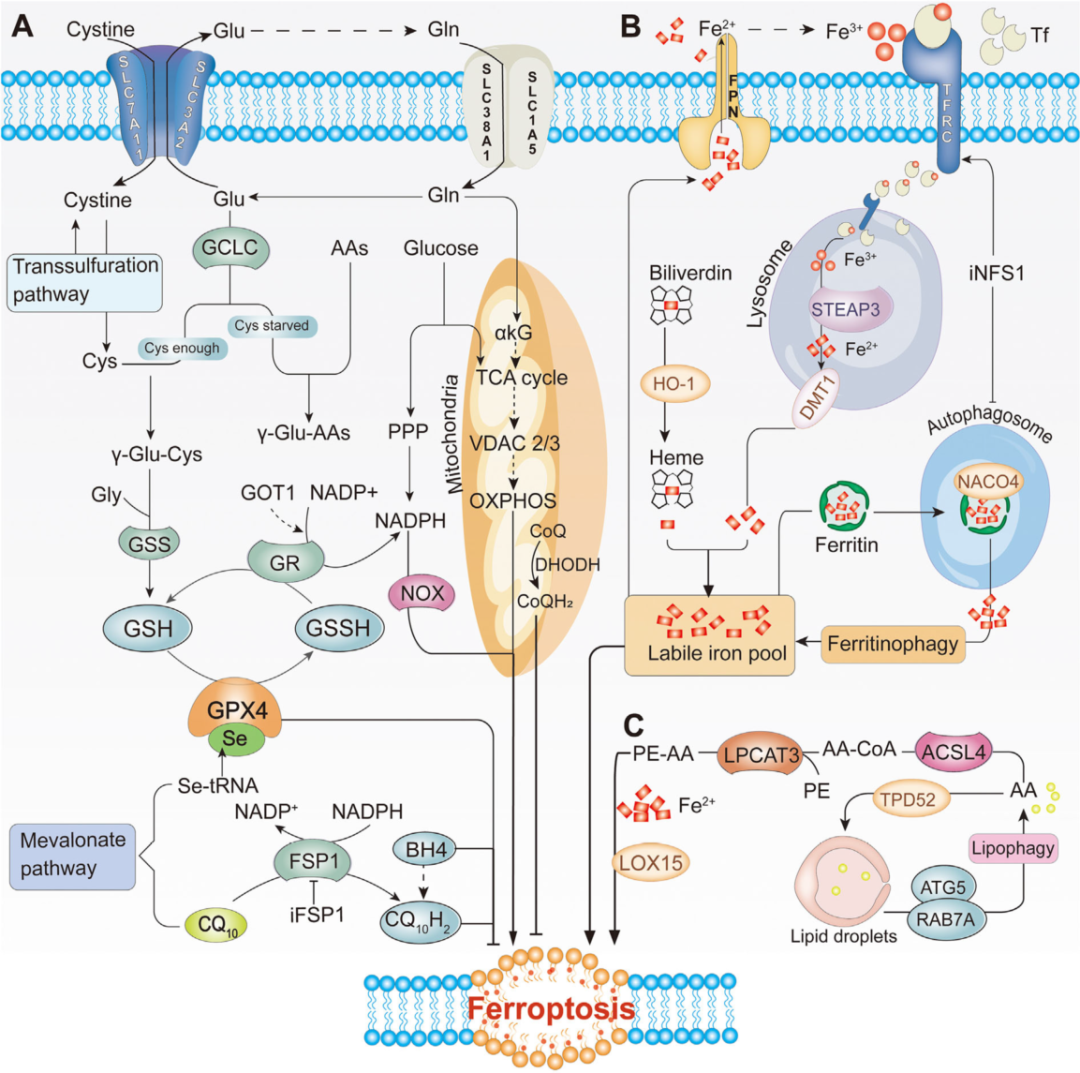
铁死亡代谢途径
铁死亡是由于ROS的积累导致脂质过氧化引起的,ROS的积累超过了谷胱甘肽 (GSH) 和GPX4的氧化还原含量。铁、脂质和活性氧在细胞存活中发挥着不可替代的作用。然而,过度依赖是一把双刃剑。这三者在稳定状态下维持正常的身体功能,并在发生代谢紊乱时对细胞造成致命打击。铁死亡涉及的复杂生物过程是由抗氧化剂、铁和脂质动力学的不平衡引起的。然而,它们在癌症发生和转移中的作用和贡献仍不清楚。
A)抗氧化代谢。GPX4和CoQ10是抗氧化代谢的两条平行途径。GPX4通过GSH的代谢发挥抗氧化作用。CoQ10在FSP1的作用下被还原为CQ10H2,通过捕获脂质过氧化自由基来抑制脂质过氧化。
B)铁代谢。作为“生物元素”之一,富氧环境中的铁可以通过与不同类型的磷脂氢过氧化物和脂质(脂肪酸)氢过氧化物的芬顿反应产生ROS。铁与Tf结合并通过TFRC 释放到细胞质中。Ferritin释放大量由NACO4介导的铁-铁自噬。血红素在HO-1的催化下释放铁。FPN可以将铁从细胞转运至血液。
C)脂质代谢。脂质产生是生存的基础,脂质过氧化是铁死亡的生物标志物。AA/AdA通过ACSL4和LPCAT3转化为多不饱和脂肪酸(PE-AA)。脂质合成、储存和降解之间的平衡也可以控制铁死亡过程。乙酰辅酶A在AC合酶的作用下也能产生PUFA,在Fe2+和LOX15的作用下立即产生大量的ROS。
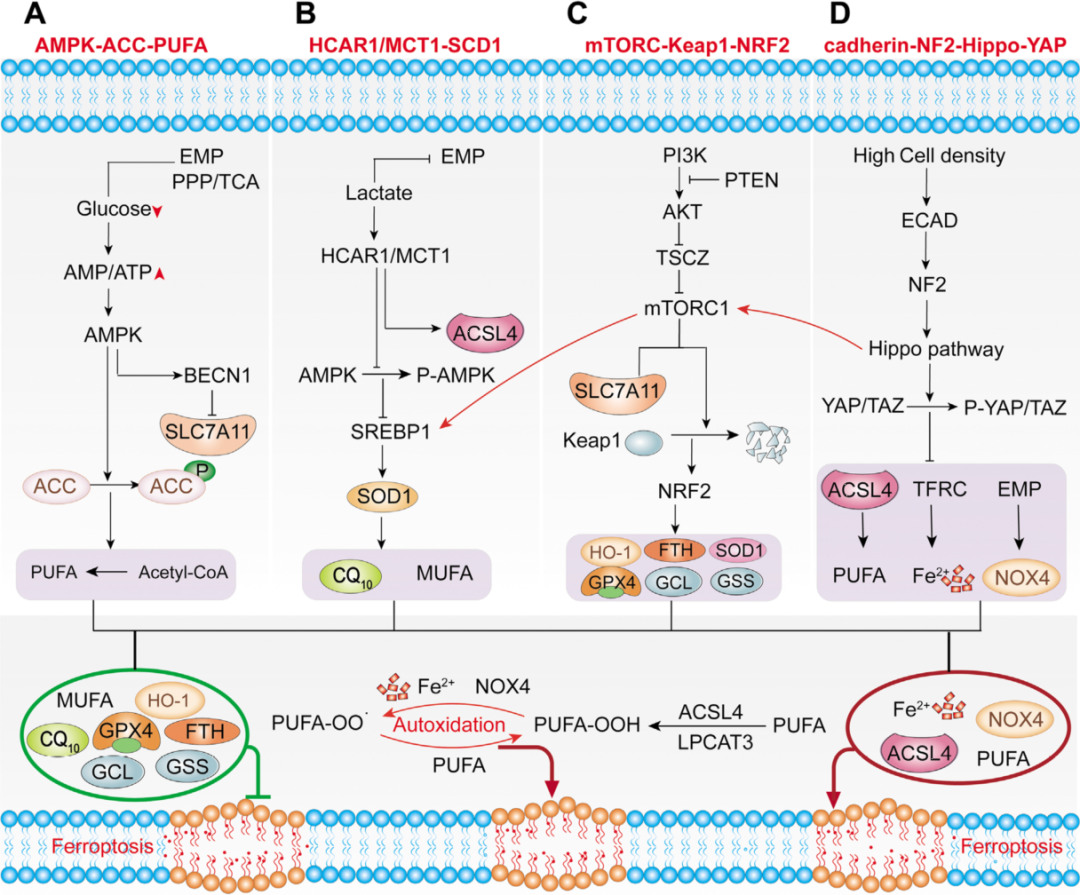
铁死亡与癌症中的经典细胞信号通路之间的“交叉对话”
如前所述,由脂质过氧化诱导,铁死亡以细胞类型和特定环境的方式控制许多过程。 然而,铁死亡在机体中的作用仍然难以捉摸。许多研究表明,抗氧化、铁和脂质代谢对铁死亡的协同调节影响特定类型癌细胞的发生和发展。然而,铁死亡与其他信号通路之间的“交差对话”尚不清楚。这篇综述讨论了铁死亡与癌症中其他经典细胞信号通路之间的串扰,以提供癌症免疫治疗靶点。
A)能量代谢途径。能量代谢激活的AMPK-ACC-PUFA通路减少了多不饱和脂肪酸PUFA的合成,从而抑制了铁死亡。
B)HCAR1/MCT1-SREBP1-SCD1通路。肿瘤代谢产生的乳酸除了形成易发生肿瘤转移的微环境外,还可能通过HCAR1/MCT1-SREBP1-SCD1通路抑制肿瘤细胞的铁死亡,为其转移和发展提供潜力。
C)PI3K-AKT-mTOR通路。尽管肿瘤代谢激活的能量应激和乳酸信号通路,细胞的主要生长调节子mTORC1和另一种不同的mTOR激酶复合物mTORC2也已被证明参与铁死亡的调节。
D)Cadherin-NE2-Hippo-YAP通路。最近的研究还表明,邻近细胞也可以通过E-cadherin介导的相互作用激活NF2和Hippo信号通路,从而抑制肿瘤细胞的铁死亡。
铁死亡和抗肿瘤治疗
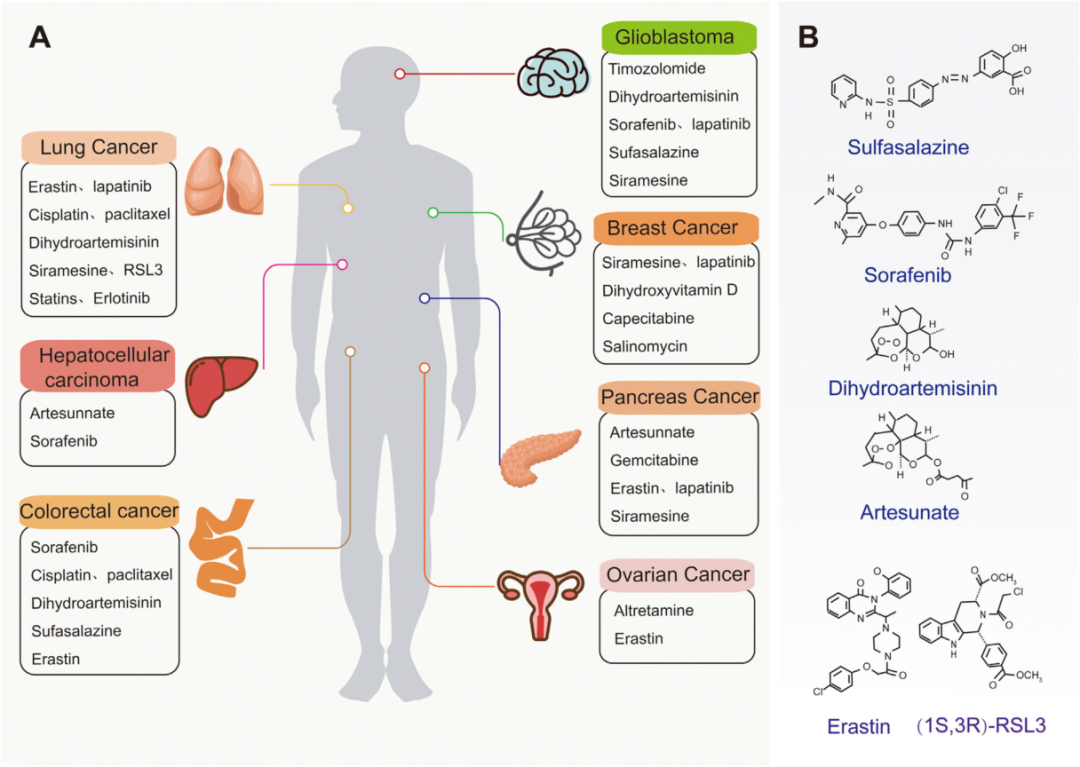
目前的癌症治疗无法有效应对癌细胞对现有化疗药物的耐药性。许多研究表明,铁死亡在杀死肿瘤细胞和抑制肿瘤生长方面起着至关重要的作用。铁死亡已被确定为非小细胞肺癌、乳腺癌、胰腺癌、肝细胞癌和其他致肿瘤细胞死亡的原因。因此,靶向诱导铁死亡可能是一种新的癌症治疗策略。下图为铁死亡的经典癌症及相应的治疗药物,以及铁死亡疗法中治疗癌症的的小分子。
铁死亡和肿瘤免疫治疗
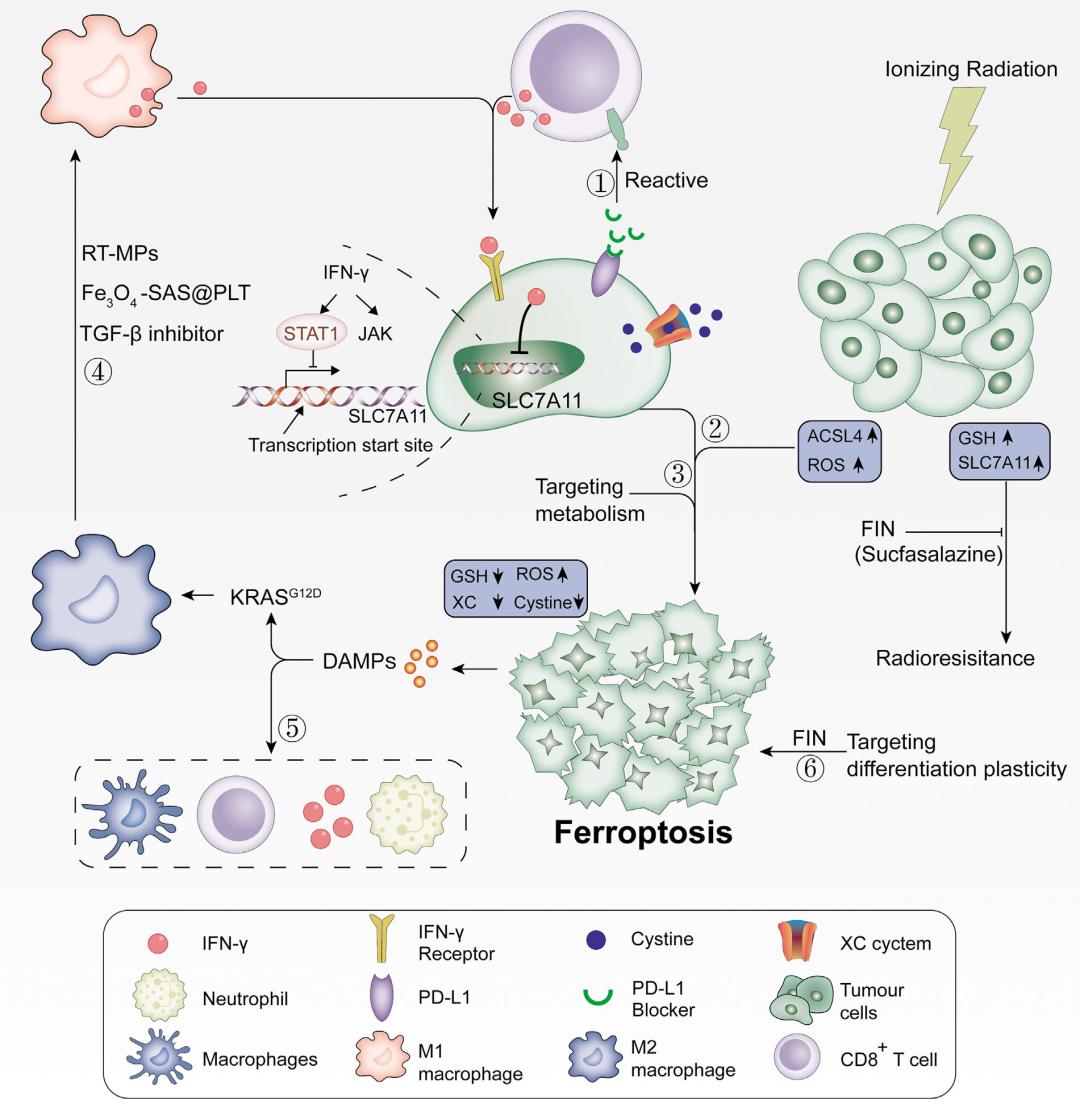
CD8+ T细胞通过释放IFNγ下调SLC3A2和SLC7A11抑制肿瘤细胞胱氨酸摄取,同时辅助免疫检查点抑制剂PD-L1,可协同增强T细胞介导的抗肿瘤免疫,诱导肿瘤细胞铁死亡。铁死亡依赖于葡萄糖和谷氨酰胺,通过阻碍代谢选择性靶向肿瘤细胞具有广阔的前景。发生铁死亡的癌细胞在体外释放的DAMP可以诱导树突状细胞的成熟、CD8+ T细胞的交叉诱导、IFN-γ的产生和M2巨噬细胞的产生。随后,激活肿瘤微环境的适应性,形成免疫反应的正反馈。放疗通过上调ACSL4,同时用铁死亡诱导剂(FINs)灭活SLC7A11或GPX4产生大量ROS,使抗辐射癌细胞对放疗敏感,逆转对放疗的抵抗。不同分化阶段的癌细胞对铁死亡的敏感性不同,可根据其分化状态实施靶向治疗。总的来说,这些研究结果表明,基于铁死亡与肿瘤免疫治疗、化学疗法和放射疗法的相互作用,铁死亡在免疫治疗中的重要作用,从而表明铁死亡在癌症治疗中的巨大潜力。
文章来源:小张聊科研