无驱动基因突变的非小细胞肺癌(NSCLC)免疫检查点抑制剂(ICI)治疗可显著改善患者预后。基于《新英格兰医学杂志》(NEJM)等顶级期刊发表的相关研究结果,我们梳理了NSCLC免疫治疗近期重要进展及未来研究方向。本期重点探讨ICI新辅助与辅助治疗NSCLC,下期将讨论转移性NSCLC的免疫疗法。
20%~25%的NSCLC患者可手术治疗,然而30%~55%接受根治性手术的患者复发并最终死于NSCLC。新辅助化疗联合手术仅可将5年无复发生存率和总生存率提高5~6个百分点,约4%的患者获得病理学完全缓解(pCR)。
初步探索
早期NSCLC患者应用ICI新辅助治疗有特别价值,因为未切除肿瘤中存在新抗原和肿瘤内免疫细胞,可能增强免疫激活效果。
NEJM早在2018年发表的一项纳武利尤单抗新辅助治疗可手术切除的早期(Ⅰ、Ⅱ或ⅢA期)NSCLC患者2期试验结果拉开了ICI新辅助治疗的序幕,其显示2剂纳武利尤单抗新辅助治疗不影响手术计划,9例(45%)患者获得主要病理学缓解(MPR,残余存活肿瘤细胞≤10%),2例(10%)获得pCR。24个月无复发生存率为69%。在9例可评估患者中,8例患者肿瘤和外周血T细胞克隆数量在PD-1阻断治疗后有所增加。此外,1例患者原发肿瘤新抗原特异性T细胞克隆在治疗后外周血中克隆扩增,提示肿瘤导向的克隆T细胞群可能在手术后继续存在,并免疫监视微转移灶。
在随后开展的一系列PD-1/PD-L1抑制剂单药或联合CTLA-4抑制剂新辅助治疗NSCLC的2期试验中,ICI单药或联合治疗对手术没有不良影响,MPR率约14%~45%,ICI单药和双药的pCR率分别达16%和29%。但ICI双药治疗的安全性问题凸显,其中一项试验因≥3级免疫相关不良事件发生率高达33%而中断。
化疗可诱导肿瘤细胞溶解、释放肿瘤抗原以增强免疫应答,且临床试验表明化疗+免疫治疗显著改善转移性NSCLC预后,因此人们开始探索ICI联合化疗新辅助治疗NSCLC的疗效。在2020年发表于Lancet Oncol的NADIM试验中,可切除的ⅢA期NSCLC患者接受纳武利尤单抗+化疗新辅助治疗,接受手术的患者全部获得R0切除,83%患者获得MPR,63%患者pCR。3年总生存率和无进展生存率分别为81.9%和69.6% 。另外一项2期试验评估了阿替利珠单抗+化疗新辅助治疗IB~ⅢA期NSCLC(77%为ⅢA期)的疗效,结果显示87%的患者获得R0切除,MPR和pCR率分别为57%和33%。大多数≥3级毒性反应与化疗相关。
ICI新辅助治疗终获3期试验证实
2022年4月,NEJM在线发表CheckMate 816研究结果。在该试验中,ⅠB~ⅢA期NSCLC患者被随机分组,分别在新辅助治疗中接受3个周期纳武利尤单抗联合含铂双药化疗或接受单纯化疗,之后两组均接受确定性手术。主要终点是无事件生存期(EFS)和pCR率。纳武利尤单抗+化疗组的中位EFS为31.6个月,单纯化疗组为20.8个月(HR,0.63)。值得关注的是,纳武利尤单抗+化疗组的pCR为24.0%,而单纯化疗组仅为2.2%(OR,13.94)。获益见于该试验分析的所有亚组。与单纯化疗组相比,纳武利尤单抗+化疗组的微创手术比例较高,全肺切除术比例较低,未观察到手术延迟,两组治疗相关不良事件也无明显差异。
基于该项研究结果,美国食品药品管理局(FDA)于2022年3月批准纳武利尤单抗联合化疗新辅助治疗可切除的NSCLC(≥4 cm)。ICI新辅助治疗将具有确切生物学基础的创新疗法与肿瘤应答及时评估相结合,有助于降低早期肺癌患者相关死亡率,其广泛实施可能预示肺癌治疗迈入新时代。
ICI术后辅助治疗
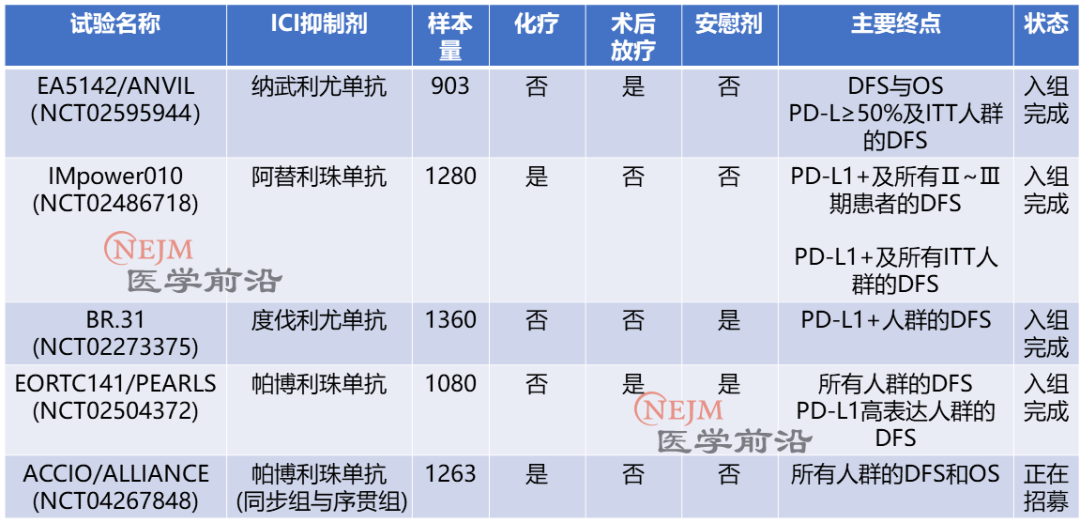
术后辅助化疗是早期(IB-ⅢA)NSCLC患者标准疗法,但5年生存率仅改善约5%。目前,多项探索ICI辅助治疗早期NSCLC的3期试验正在进行中(表1)。
表1. ICI辅助治疗NSCLC的3期试验(改变自[5])
IMpower010是一项多中心、开放标签、随机对照3期试验,纳入肿瘤完整切除的IB(T≥4 cm)~ⅢA期 NSCLC患者,入组患者接受以顺铂为基础的辅助化疗,化疗后无进展患者1:1随机分配接受16个周期的阿替利珠单抗或最佳支持治疗。经过32.2个月中位随访,在Ⅱ~ⅢA期患者中,与最佳支持治疗相比,阿替利珠单抗组无病生存率(DFS)优于最佳支持治疗,但对于意向治疗人群(IB-ⅢA期NSCLC),虽然阿替利珠单抗组总体趋势更优(HR,0.81;95% CI,0.67~0.99),但DFS未达到统计学显著性。
基于这项2021年发表于Lancet的研究结果,阿替利珠单抗获FDA批准用于手术和含铂化疗后PD-L1≥1%的Ⅱ~ⅢA期NSCLC的辅助治疗。然而探索性分析表明,DFS改善主要由PD-L1≥50%的人群驱动,在PD-L1表达1%~49%的人群中,辅助免疫治疗DFS获益有限(HR,0.87;95% CI,0.60~1.26)。
2022年3月,PEARLS/KEYNOTE-091试验DFS结果公布。该项试验纳入肿瘤完整切除的IB(T≥4 cm)~ⅢA期NSCLC患者,入组患者随机分配接受18个周期的帕博利珠单抗或安慰剂治疗。在总体人群中,帕博利珠单抗的DFS明显优于安慰剂(53.6个月 vs. 42.0个月;HR,0.76;95% CI,0.63~0.91)。然而,在PD-L1≥50%患者中,帕博利珠单抗组和安慰剂组DFS相似(HR,0.82;95% CI,0.57~1.18)。
放化疗后ICI辅助治疗不可切除Ⅲ期NSCLC
2017年之前,放化疗是不可切除的Ⅲ期NSCLC标准治疗,无论是否联合诱导化疗或巩固化疗、抗血管生成等疗法,患者生存结局均未见改善。2018年底发表于NEJM的PACIFIC研究证实,Ⅲ期NSCLC患者在完成放化疗后12个月内接受度伐利尤单抗治疗可显著改善无进展生存期(17.2个月 vs. 5.6个月;HR,0.51;95% CI,0.41~0.63)。总生存期(OS)亦显著获益,度伐利尤单抗组和安慰剂组的24个月OS分别为66.3% vs. 55.6%(HR,0.68;99.73% CI,0.47~0.997)。度伐利尤单抗辅助治疗未显著增加不良事件风险。
需要指出的是,在PACIFIC设计之时尚未明确免疫治疗生物标志物,未根据PD-L1表达水平对患者分层,而且仅有63%的入组患者有PD-L1表达水平数据。一项事后分析显示,PD-L1表达≥25%的患者DFS(HR,0.41)和OS(HR,0.50)获益较大。另一项事后分析发现,全人群DFS均可获益,但PD-L1阴性亚组(PD-L1<1%)OS无获益。基于这些结果,欧洲药品管理局(EMA)仅批准该疗法用于PD-L1≥1%的患者,但美国和其他国家无此限制。
PACIFIC研究确立了ICI在不可切除Ⅲ期NSCLC患者中的治疗地位,更多关于在化疗期间或之后给与其他ICI的研究正在进行中。
RECIST局限性
研究者传统上应用影像学评估实体瘤对全身治疗的应答,但实体瘤疗效评价标准(RECIST)无法准确评估ICI新辅助治疗。根据RECIST标准,部分接受ICI新辅助治疗时出现疾病进展的患者,在手术切除时被发现有病理学退缩,这是由于免疫细胞浸润而非肿瘤进展。除了认识到客观缓解率可能不是ICI新辅助治疗试验的合适终点外,临床医生在制定手术计划时也应该意识到这些因素。
替代终点
病理学替代终点(pCR和MPR)在ICI新辅助治疗中的价值尚不明确。新辅助化疗的研究数据证实这些终点与生存率存在正相关。CheckMate 816试验的探索性分析显示获得pCR患者的EFS优于未获得pCR的患者。目前,在新辅助免疫+化疗治疗方案中,pCR或MPR能在多大程度上预测肿瘤的长期控制以及围手术期ICI治疗对可切除NSCLC的OS影响仍未明确。
新辅助与辅助治疗的联合
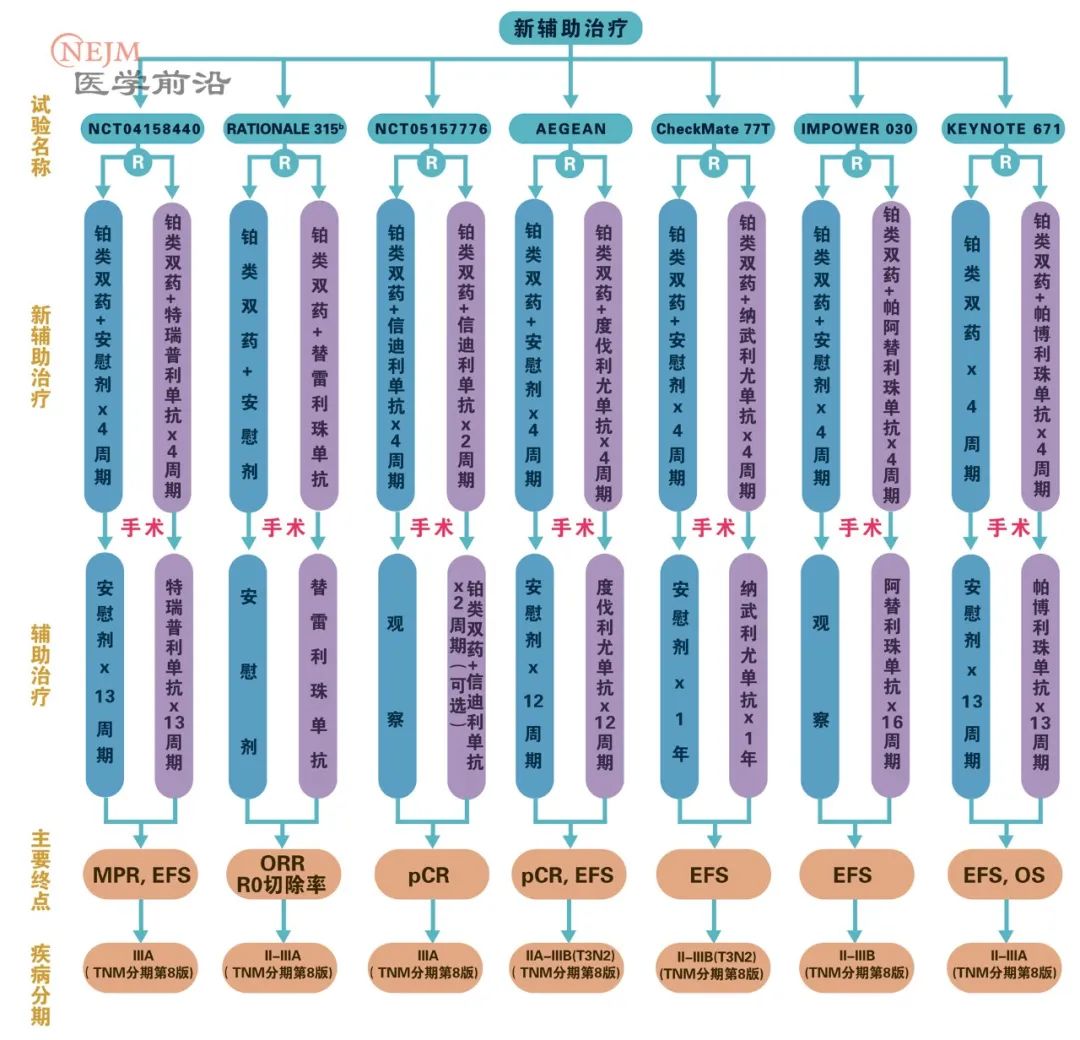
术后是否给与ICI+化疗辅助治疗这一问题尚未回答,多项在研3期试验试图回答这一问题(表2)。此外,新辅助治疗获得pCR后以及分期较早的NSCLC患者是否需要辅助治疗,尤其值得探讨。
表2. 进行中的ICI新辅助与辅助治疗3期试验(改编自[6])
治疗期限
CheckMate 816是目前ICI新辅助治疗唯一报告结果的的研究,入组患者接受3个周期纳武利尤单抗联合含铂双药化疗,而其他正在进行的ICI新辅助和辅助治疗研究都包括1年的ICI治疗。无论是3个周期还是1年治疗期限,可能都是一个相对随意的时间,还需要临床研究给予探索。是否应该根据病理学缓解制定治疗期限?能否为新辅助治疗缓解率划定分界线,以表明辅助治疗获益?这些都是未来研究需要解决的问题。
PD-L1与肿瘤突变负荷
前已述及,同样是辅助治疗,IMpower010和KEYNOTE-091研究对于PD-L1表达水平与疗效的结论截然相反。NADIM试验发现PD-L1或TMB与生存结局无相关性。在CheckMate 816试验中,与PD-L1阴性肿瘤患者相比(HR,0.85),PD-L1阳性亚组中观察到纳武利尤单抗+化疗的获益幅度更大(PD-L1≥1%,HR,0.41;PD-L1≥50%,HR,0.24)。但无论TMB高低,纳武利尤单抗+化疗与化疗相比获益均无显著差异。因此,PD-L1与肿瘤突变负荷都不是理想的NSCLC免疫新辅助治疗生物标志物。
循环肿瘤DNA
通过液体活检对循环肿瘤DNA(ctDNA)进行动态评估,有助于改善肺癌个体化治疗。在NADIM试验中,治疗前ctDNA水平较低与PFS和OS改善相关,而新辅助治疗后检测不到ctDNA与PFS和OS更优相关。
CheckMate 816试验中有89例患者的ctDNA水平可以评估。ctDNA清除患者与未清除患者相比,无事件生存期似乎较长,而且ctDNA清除患者pCR百分比更高。在临床试验中纳入ctDNA评估,可能有助于识别那些通过手术和围手术期短期治疗(新辅助治疗)便可能治愈的患者,从而避免昂贵且有潜在毒副作用的辅助治疗。
基因检测
大多数ICI新辅助治疗试验将携带EGFR或ALK突变的非鳞状NSCLC患者排除在外,而ICI辅助治疗以及转移性NSCLC治疗试验中则纳入一小部分EGFR或ALK驱动基因阳性患者。现有证据显示,在携带大多数致敏突变的NSCLC患者中,ICI单药治疗难以获益,这部分患者应优先考虑靶向治疗。
然而,中国3期试验ORIENT-31结果提示,ICI联合疗法能够显著延长EGFR-TKI治疗后进展的EGFR突变晚期非鳞状NSCLC的PFS,而且ICI+化疗新辅助治疗的临床和病理学反应可能因特定的基因突变而不同,因此新辅助治疗试验有必要明确ICI联合疗法在肿瘤驱动基因阳性NSCLC患者中的价值。
此外,NEJM在上个月报道12例错配修复基因缺陷(dMMR)型直肠癌接受6个月帕博利珠单抗新辅助治疗结果,全部患者获得临床缓解(参见《变革初露端倪:免疫治疗让局部晚期dMMR直肠癌完全缓解|NEJM》)。尽管肺癌患者中仅有1.16%为dMMR型,但肺癌患者数量庞大,这部分患者接受ICI新辅助治疗能否获得类似结局也值得探讨。
新辅助治疗对手术影响
在早期NSCLC围手术期治疗决策时,必须考虑其对外科手术的影响。新辅助治疗可能诱发高级别毒性反应,从而影响手术。此外,ICI治疗可能引起炎症反应和组织纤维化,导致手术时间延长,或从微创手术被迫转为开放手术。
参考文献