说起“神药”,大家多半会想到二甲双胍、阿司匹林这种,不过,根据奇点糕的人生经验,很多人好像把抗生素也当成半个“神药”,有个感冒或者头疼脑热就先来点儿,这可真不是什么好习惯,搞不好,抗生素还要挡了免疫系统的道呢!
近日,来自瑞典斯德哥尔摩大学分子生物科学系以及分子感染医学中心(NIMS)的副教授Nelson O Gekara及团队在《免疫》杂志发表了一篇文章[1]。
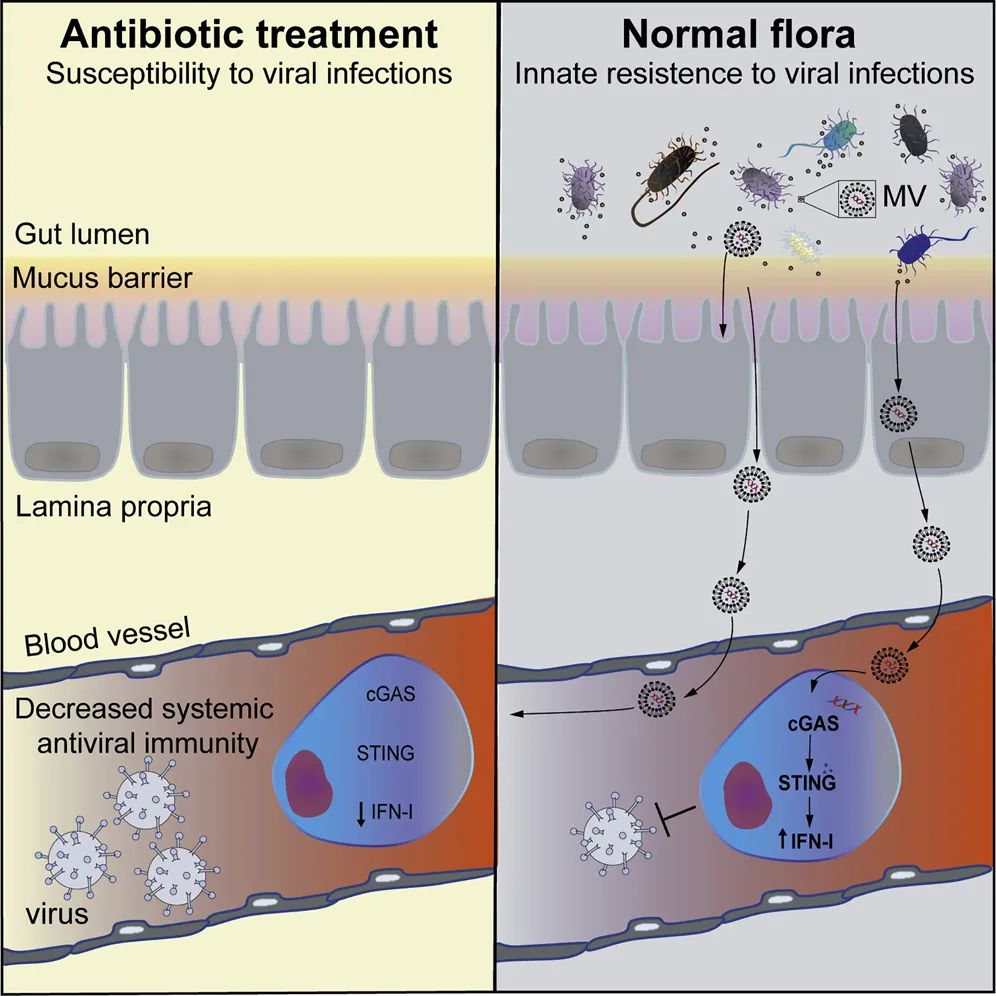
他们发现,肠道菌群释放的膜泡可以通过血液循环到达不同器官并与宿主细胞融合,膜泡中的DNA片段通过激活胞浆cGAS-STING-IFN-I轴提高宿主体内I型干扰素的水平,起到防范病毒入侵以及加快肺部或系统性病毒感染清除的作用,而抗生素的使用会大量降低肠道菌群的生物量和多样性,使得I型干扰素水平无法维持,增加宿主对病毒的易感性。
图1. 文章封面截图
肠道菌群对我们身体健康所做的一个重要贡献就是抵御食物或其他来源的病原体的定植。俗话说不干不净,吃了没病,现在更科学的解释是肠道菌群阻止了病原微生物和肠道上皮细胞接触的机会,或抑制了病原微生物的繁殖,使得它们还没来得及搞破坏就已经被人体排泄出去。
肠道菌群抑制病原细菌的机制研究的相对充分一些,比如竞争代谢产物、分泌针对病原菌的毒素,或者上调宿主细胞的免疫杀伤功能[2],更快消灭病原菌。很多特定的菌株还被应用于治疗或预防沙门氏菌和艰难梭菌的感染,进入了临床试验阶段。但肠道菌群对病毒感染的防治作用及其机制还不明确。
于是Nelson O Gekara及其团队通过体内体外实验试图回答肠道菌群的完整性是否影响宿主对病毒感染的抗性。实验使用了I型单纯疱疹病毒(HSV-1)感染小鼠模型,分别通过滴鼻和腹腔注射诱导肺部感染和系统性感染。
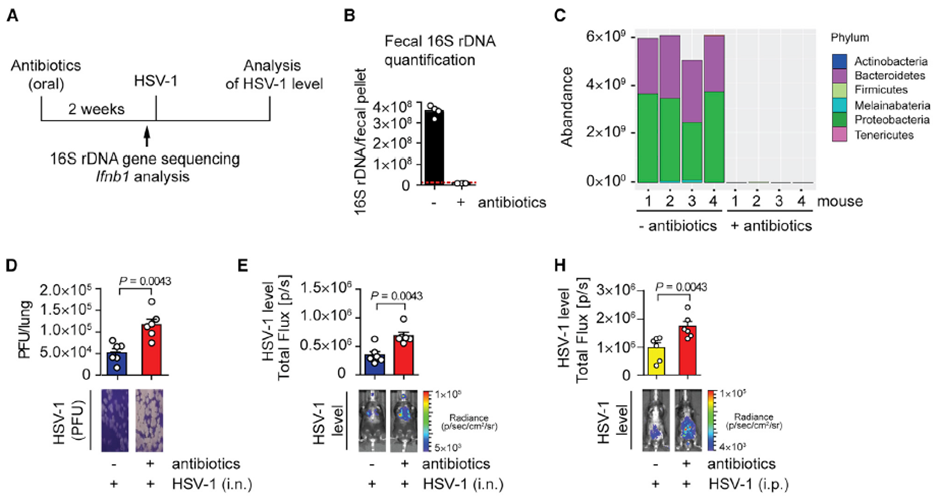
其中一组小鼠在感染前通过饮用水口服了两周氨苄青霉素、新霉素和万古霉素,对小鼠粪便样品进行16S rRNA 测序结果显示,服用抗生素的小鼠肠道菌群几乎被 “清零” ,尤其是曾经占主导的拟杆菌门和变形菌门几乎全部消失。而这些服用抗生素的小鼠在感染HSV-1 48小时后肺部和腹部的病毒载量都显著高于未服用抗生素的对照组,并且小鼠体温的下降和疾病的评分也显著高于对照组。说明抗生素对肠道菌群的破坏与宿主对HSV-1易感性增加存在关联。
图2. 抗生素服用后肠道菌群组分的变化以及HSV-1感染后不同部位的病毒载量
人体抗病毒最重要细胞因子之一就是I型干扰素[3],这一细胞因子在没有感染的情况下通常处于较低的水平,当病毒入侵时则会快速启动响应,激活各类免疫细胞清除病毒。那么抗生素的服用对体内I型干扰素的基础水平有无影响呢?
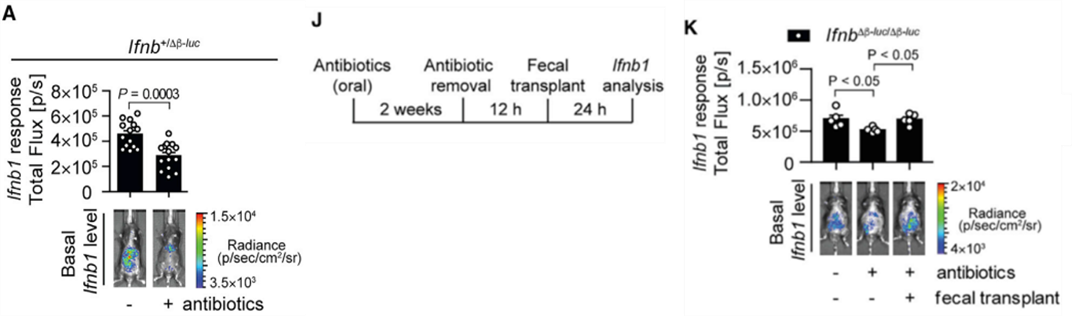
实验使用了带有特定荧光标记Ifnb1基因的小鼠,分别令其口服抗生素或仅饮用水,发现服用抗生素的小鼠Ifnb1的表达显著下降。除此之外,给小鼠服用抗生素后再进行粪菌移植恢复其肠道菌群,短短24小时就使I型干扰素的水平增加到了原有水平。说明这些被抗生素消灭的肠道菌群有着刺激和维持Ifnb1表达的作用。
更重要的是,当科研人员们给干扰素受体基因 (Ifnar-/-)缺失的小鼠服用了抗生素并感染HSV-1时,这些小鼠与未服用抗生素的对照组Ifnar-/-小鼠的肺部和血液中的病毒载量并无差异,并且都高于野生型小鼠。这样看来,I型干扰素的下降是服用抗生素导致病毒蔓延的重要原因之一。
图3. 服用抗生素前后以及粪菌转移前后I型干扰素的水平
那么肠道菌群究竟是如何刺激宿主细胞表达并维持相对较高水平的I型干扰素呢?
诱导I型干扰素表达的通路有TLR-Myd88,RIR-IPS1/MAVS,cGAS-STING[4-6],可以识别细胞内和细胞外的多种细菌产物,如脂多糖(LPS)或RNA、DNA片段。科研人员们分别构建了不同的基因敲除小鼠,发现在STING基因缺失的小鼠中I型干扰素的表达量最低,而缺失TLR信号通路的小鼠I型干扰素的表达则不受影响,说明肠道菌群对I型干扰素的上调依赖于STING通路而非TLR通路。
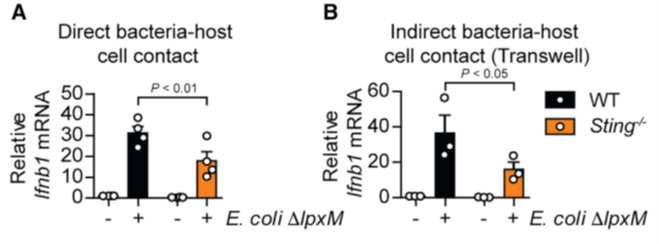
接着,科研人员们用肠道菌群中常见的大肠杆菌与小鼠骨髓来源的巨噬细胞进行共培养,发现即使大肠杆菌不与细胞接触同样能够上调I型干扰素的表达,而STING缺失小鼠的巨噬细胞不论是否与细菌接触,I型干扰素的表达都远远低于野生型小鼠。这些结果表明大肠杆菌分泌的某些产物通过STING激活了I型干扰素。
图4. 大肠杆菌与BMDM共培养不同条件下对I型干扰素的激活效果
科研人员们分离了大肠杆菌分泌的膜泡(MVs)并通过腹腔注射到小鼠体内,两周后再感染HSV-1,发现膜泡能够上调I型干扰素水平,降低病毒载量。而且这些膜泡中的DNA正是通过cGAS-STING通路启动了I型干扰素的表达,当膜泡结构被破坏或宿主细胞缺失cGAS或STING,这一抗病毒感染的保护效果均会缺失。注入肠道菌群中常见的其他细菌的膜泡同样能起到这样的作用。
最后,科研人员们在小鼠的粪便以及血液中均分离到了细菌膜泡,并对其中的DNA进行了测序,发现膜泡的来源包含厚壁菌门、变形菌门、拟杆菌门、放线菌门等众多的常见肠道菌群成分。总结下来,多种肠道细菌可以释放膜泡到血液中,膜泡游走至不同的器官与宿主细胞膜融合,其中的DNA通过cGAS-STING通路激活IFN-I的表达,当有病毒入侵时可以快速响应并启动其他免疫细胞的抗病毒作用。
图5. 文章结论总结
虽然菌群仅存在于肠腔,但他们分泌的膜泡包含的信号分子却可以遍布全身各处,除了STING信号通路外还会作用于哪些受体和下游通路呢?除了调节宿主抗病毒的能力,是否也与自身免疫性疾病等其他疾病相关呢?
这篇文章提示我们,想要了解更多肠道菌群的作用可能不仅要着眼于菌群本身,还要关注它们所分泌和释放的大大小小的结构和分子。
参考文献
1. Erttmann S F, Swacha P, Aung K M, et al. The gut microbiota prime systemic antiviral immunity via the cGAS-STING-IFN-I axis[J]. Immunity, 2022, 55(5): 847-861. e10.
2. Khosravi, A., and Mazmanian, S.K. (2013). Disruption of the gut microbiome as a risk factor for microbial infections. Curr. Opin. Microbiol. 16, 221–227.
3. Gough, D.J., Messina, N.L., Clarke, C.J., Johnstone, R.W., and Levy, D.E. (2012). Constitutive type I interferon modulates homeostatic balance through tonic signaling. Immunity 36, 166–174.
4. Kawai, T., and Akira, S. (2011). Toll-like receptors and their crosstalk with other innate receptors in infection and immunity. Immunity 34, 637–650.
5. Lienenklaus, S., Cornitescu, M., Zietara, N., qyszkiewicz, M., Gekara, N., Jab1o´nska, J., Edenhofer, F., Rajewsky, K., Bruder, D., Hafner, M., et al. (2009). Novel reporter mouse reveals constitutive and inflammatory expression of IFN-beta in vivo. J. Immunol. 183, 3229–3236.
6. Sun, L., Wu, J., Du, F., Chen, X., and Chen, Z.J. (2013). Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway. Science 339, 786–791.
文章来源:奇点网