线粒体提供高能量需求来执行肾脏的多效性功能,例如新陈代谢、营养物质的重吸收、液体和电解质的平衡。线粒体调节与组织损伤和修复密切相关的多种细胞过程,如细胞死亡、细胞增殖和分化、代谢适应和炎症(图2)。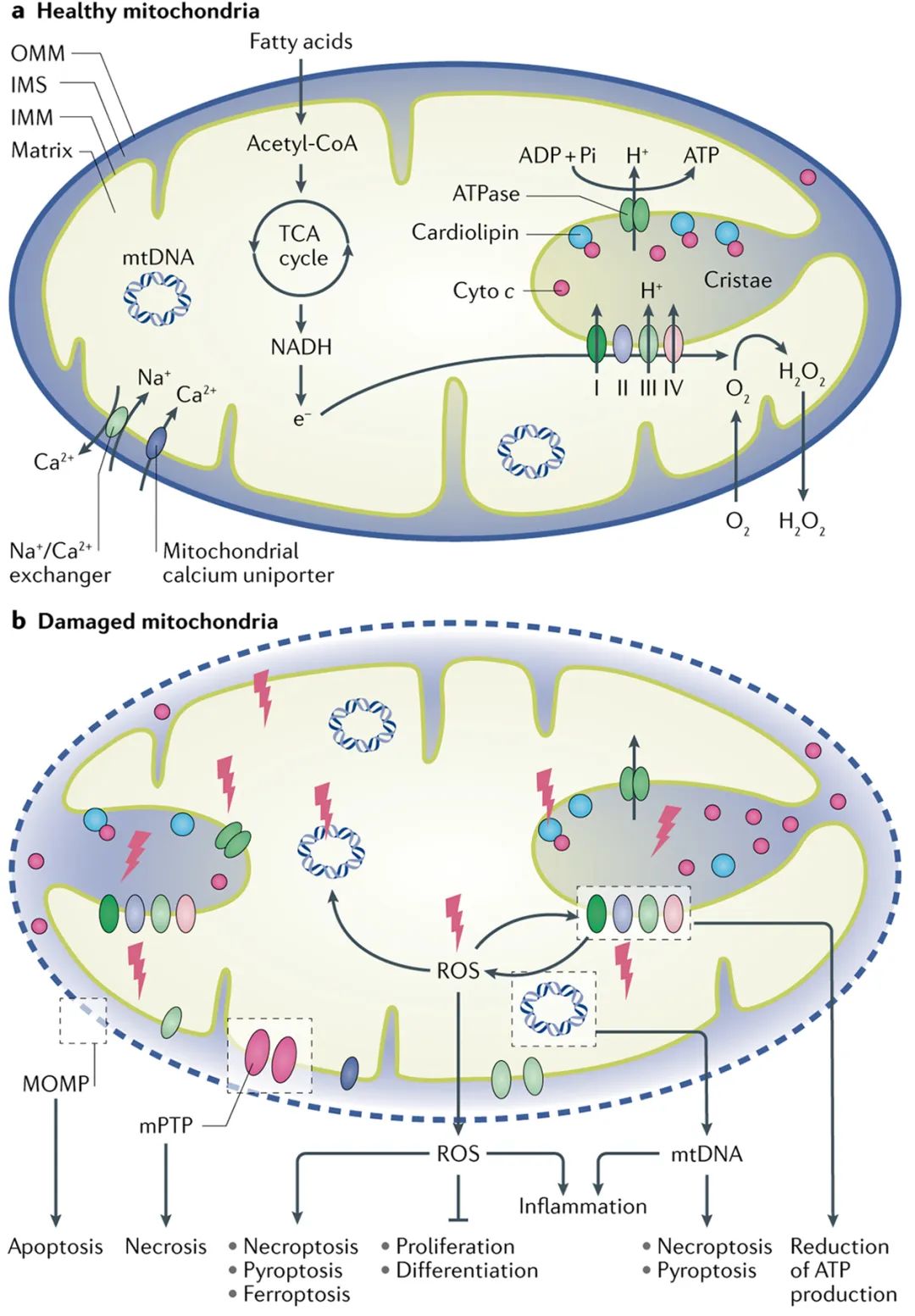
图2 线粒体功能和线粒体损伤的影响(Tang et al., 2021)。(a)线粒体在以ATP形式产生能量中起关键作用。(b)在受损线粒体中,ROS通过诱导心磷脂过氧化,导致凋亡或其他形式的细胞死亡以及细胞炎症;同时线粒体ROS的释放可通过调节各种信号通路损害细胞增殖和/或分化;且线粒体损伤会减少ATP的产生,并导致细胞能量衰竭。
线粒体自噬是针对AKI中氧化损伤的保护性反应,是一种选择性的自噬形式,可消除多余或受损的线粒体(Wang et al., 2020)。线粒体氧化应激、ROS产生与线粒体自噬之间密切相关,这些过程都参与了AKI的各种病理状况。
线粒体自噬于2005年首次提出,是细胞器特异性自噬途径之一,用于维持细胞结构和功能(图3)。研究显示,线粒体自噬启动需要:(1)线粒体碎片化以产生适合自噬隔离的线粒体;(2)启动功能失调的线粒体进行自噬识别;(3)诱导一般自噬机制将已启动的线粒体整合到自噬体中(Livingston et al., 2019)。
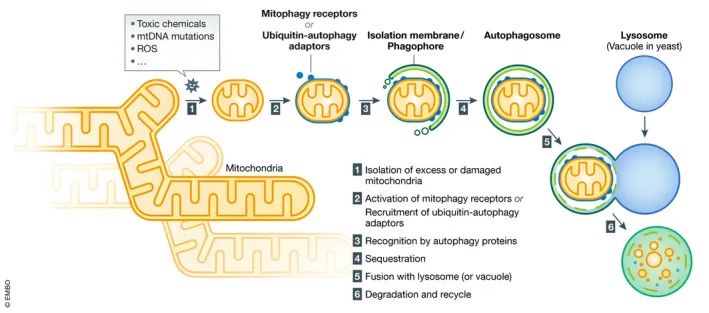
图3 线粒体自噬概述示意图(Onishi et al., 2021)。
绝大多数研究线粒体自噬在生理或病理状况中的作用的研究都集中在PINK1-PRKN通路,此外,还有一些独立于PRKN的机制可触发线粒体自噬激活,包括驱动泛素连接酶、受体和心磷脂(CL)介导的机制。
肾脏是一个重要的器官,需要大量能量来维持新陈代谢、血流动力学、酸碱和电解质平衡、营养重吸收和激素分泌,介于肾脏通过接收20%的心输出量并消耗10%的身体氧气来执行其主要功能,因此,线粒体对于强大和正常的肾功能至关重要。最近的证据表明,过量的线粒体ROS(mtROS)产生对AKI发展和肾脏修复异常至关重要。细胞ROS的主要来源是线粒体和NOX即NADPH氧化酶,线粒体利用氧气通过氧化磷酸化(OXPHOS)生成三磷酸腺苷(ATP),这是mtROS的来源之一,线粒体损伤会增加mtROS的产生;NOX是调节细胞氧化还原平衡的核心成分,所有NOX家族成员共享六个高度保守的跨膜结构域,NOXs产生的ROS还可反向引起线粒体产生ROS,这是ROS扩增或传播的重要机制途径(图4)。
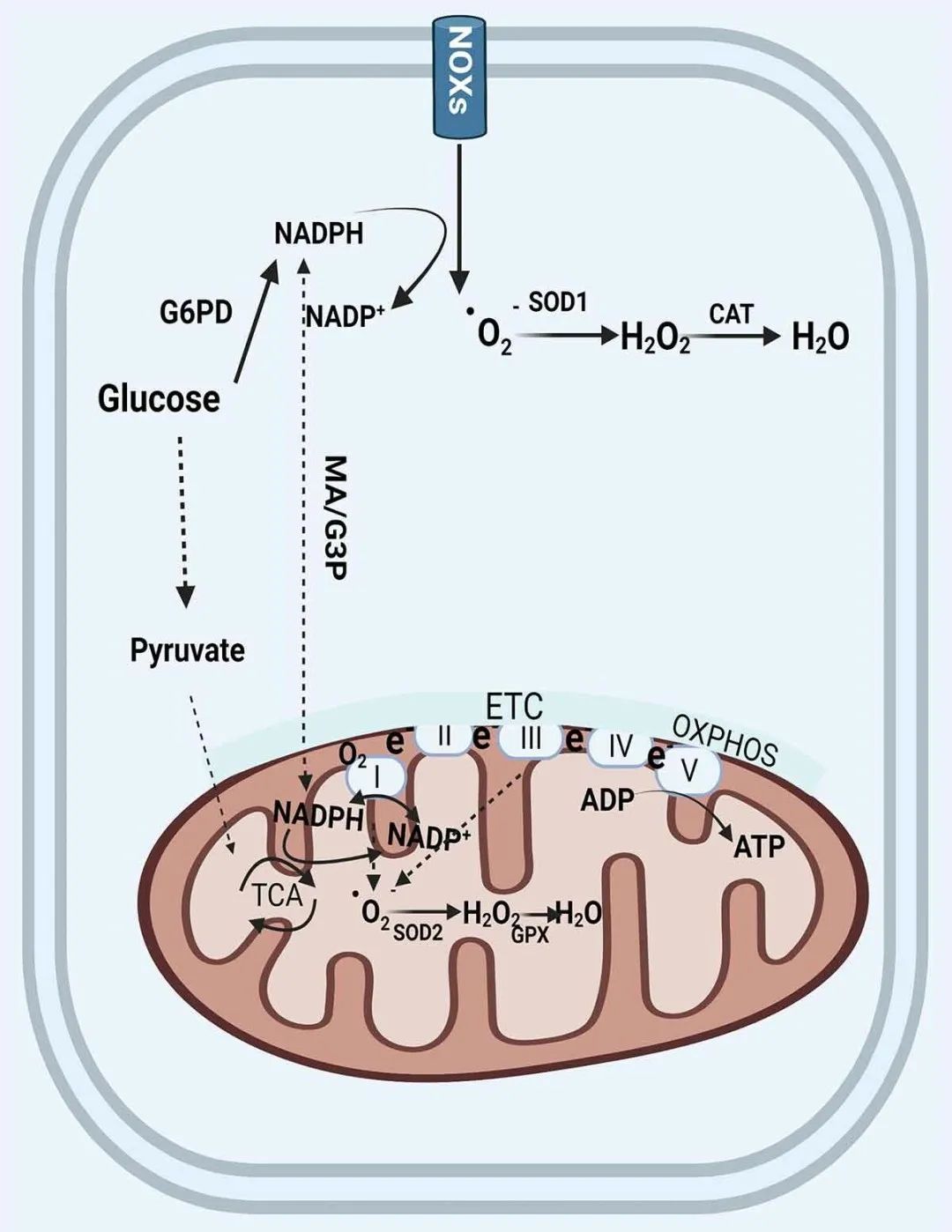
图4 线粒体ROS的产生和消除示意图(Su et al., 2022)。
目前,一系列线粒体靶向抗氧化剂已被证明可减轻AKI并加速肾脏修复。过量的mtROS会对线粒体成分造成氧化损伤,导致更多的ROS产生,最终增加肾小管细胞死亡的趋势。而与高水平mtROS的急性和破坏作用相反,mtROS的适度增加可能会激活参与AKI发病机制和肾纤维化的信号通路。例如,mtROS已被证明可调节p53、NF-κB和丝裂原活化蛋白激酶(MAPK)信号传导(Wang et al., 2020)。
肾单位富含线粒体,可氧化脂肪酸以产生ATP,最近的研究提供了大量证据,表明线粒体损伤和功能障碍对AKI发展和肾脏修复异常有重要影响。增加的氧化应激、炎症和ATP耗氧量的增加,所有这些都与AKI相关,可促进线粒体损伤,从而引发线粒体自噬(Duann P, Lin PH. 2017)。虽然线粒体自噬在AKI中的作用一直存在争议,但现在许多研究证明了线粒体自噬在AKI中的保护作用,包括PRKN非依赖性途径。下表显示了目前已报道的线粒体自噬在AKI各种病理状态中作用(Su et al., 2022)。
表 线粒体自噬在急性肾损伤各种病理状态中的作用

线粒体自噬是一种关键的细胞稳态机制,在AKI早期被激活,在AKI期间,线粒体自噬通过PRKN依赖和独立的信号通路被早期激活。在这种情况下,线粒体自噬的激活具有保护作用,减少局部炎症和氧化损伤。线粒体自噬与细胞死亡形式(如细胞凋亡、细胞焦亡)之间的串扰是导致某些形式AKI的重要原因,并且新出现的证据表明铁代谢、线粒体自噬和称为铁死亡的新型细胞死亡形式之间存在重要联系(图5)。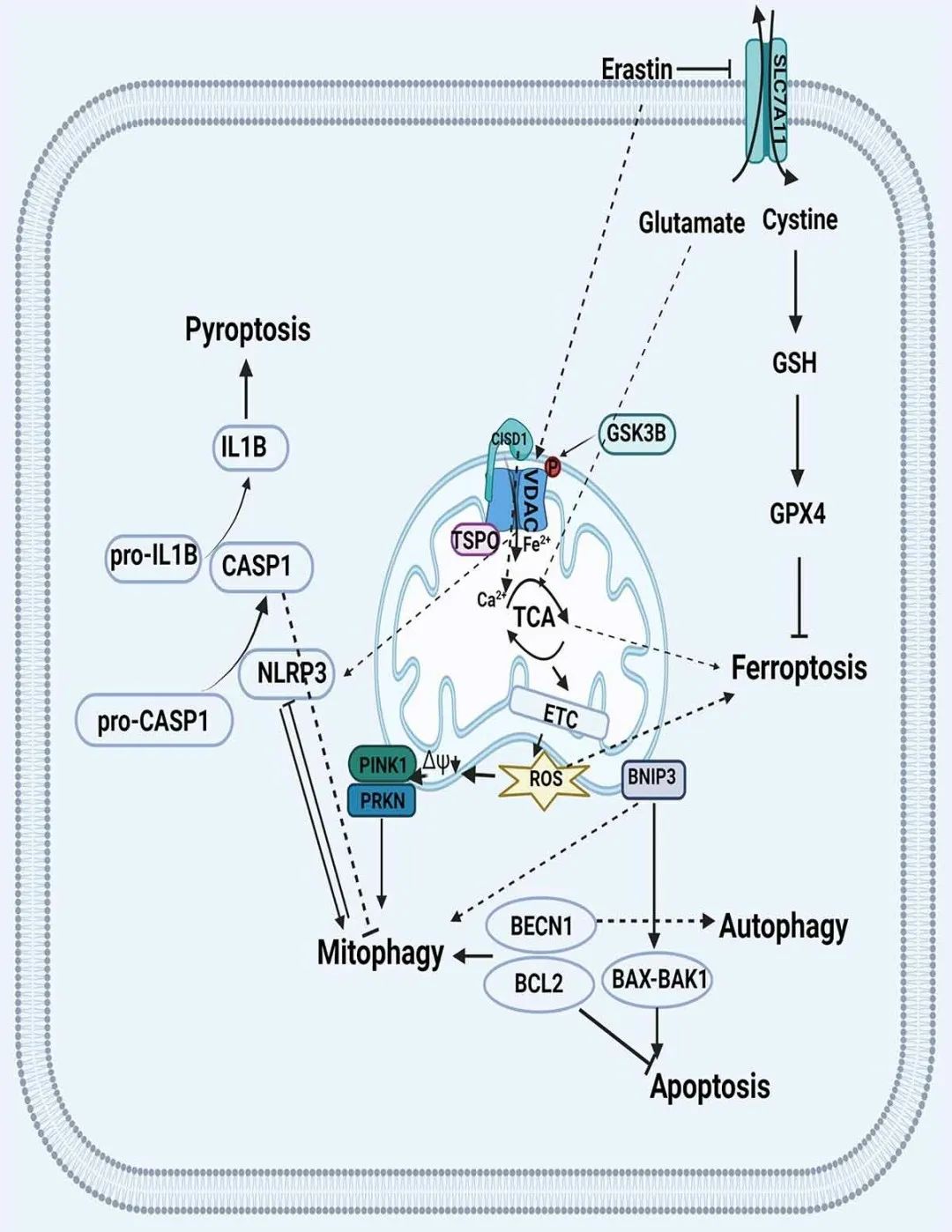 图5 线粒体自噬和其他细胞死亡形式之间的串扰示意图(Su et al., 2022)。
Duann P, Lin PH. Mitochondria Damage and Kidney Disease. Adv Exp Med Biol. 2017;982:529-551.
Livingston MJ, Wang J, Zhou J, et al. Clearance of damaged mitochondria via mitophagy is important to the protective effect of ischemic preconditioning in kidneys. Autophagy. 2019;15(12):2142-2162.
Onishi M, Yamano K, Sato M, et al. Molecular mechanisms and physiological functions of mitophagy. EMBO J. 2021;40(3):e104705.
Sancho-Martínez SM, López-Novoa JM, López-Hernández FJ. Pathophysiological role of different tubular epithelial cell death modes in acute kidney injury. Clin Kidney J. 2015;8(5):548-559.
Su L, Zhang J, Gomez H, et al. Mitochondria ROS and mitophagy in acute kidney injury. Autophagy. 2022;1-14.
Tang C, Cai J, Yin XM, et al. Mitochondrial quality control in kidney injury and repair. Nat Rev Nephrol. 2021;17(5):299-318.
Wang Y, Cai J, Tang C, et al. Mitophagy in Acute Kidney Injury and Kidney Repair. Cells. 2020;9(2):338.
图5 线粒体自噬和其他细胞死亡形式之间的串扰示意图(Su et al., 2022)。
Duann P, Lin PH. Mitochondria Damage and Kidney Disease. Adv Exp Med Biol. 2017;982:529-551.
Livingston MJ, Wang J, Zhou J, et al. Clearance of damaged mitochondria via mitophagy is important to the protective effect of ischemic preconditioning in kidneys. Autophagy. 2019;15(12):2142-2162.
Onishi M, Yamano K, Sato M, et al. Molecular mechanisms and physiological functions of mitophagy. EMBO J. 2021;40(3):e104705.
Sancho-Martínez SM, López-Novoa JM, López-Hernández FJ. Pathophysiological role of different tubular epithelial cell death modes in acute kidney injury. Clin Kidney J. 2015;8(5):548-559.
Su L, Zhang J, Gomez H, et al. Mitochondria ROS and mitophagy in acute kidney injury. Autophagy. 2022;1-14.
Tang C, Cai J, Yin XM, et al. Mitochondrial quality control in kidney injury and repair. Nat Rev Nephrol. 2021;17(5):299-318.
Wang Y, Cai J, Tang C, et al. Mitophagy in Acute Kidney Injury and Kidney Repair. Cells. 2020;9(2):338.