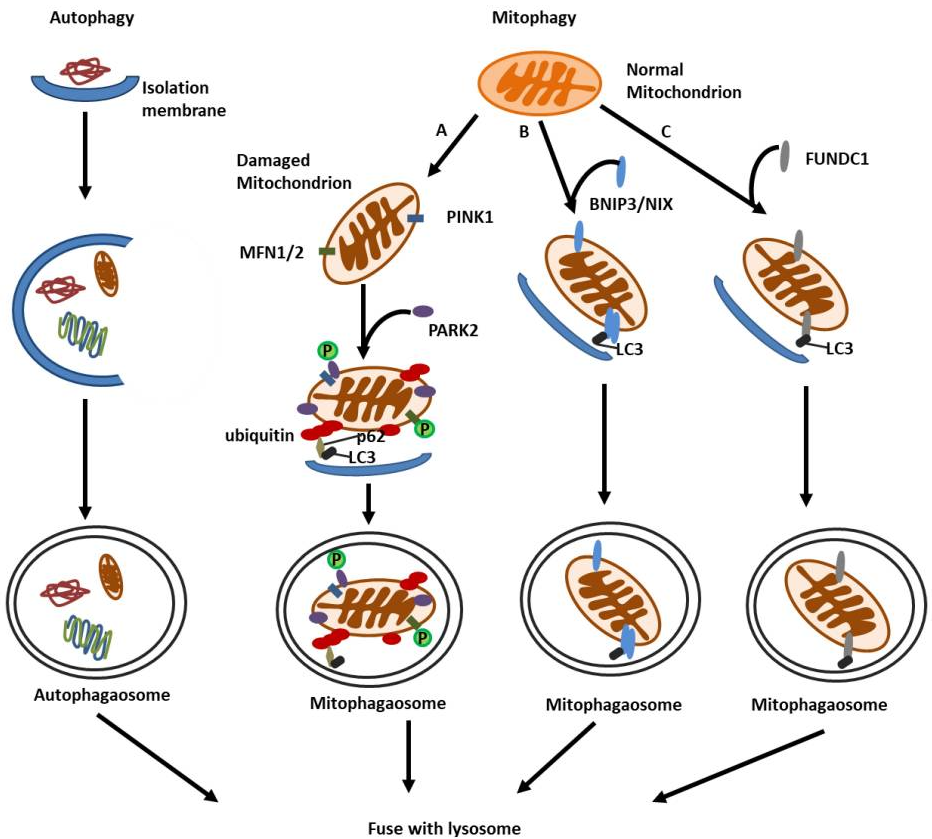
图1 自噬和线粒体自噬的分子机制示意图(Wang et al., 2020)。
接下来就和伯小医一起来看看线粒体自噬在肾功能损伤疾病中的分子机制吧!
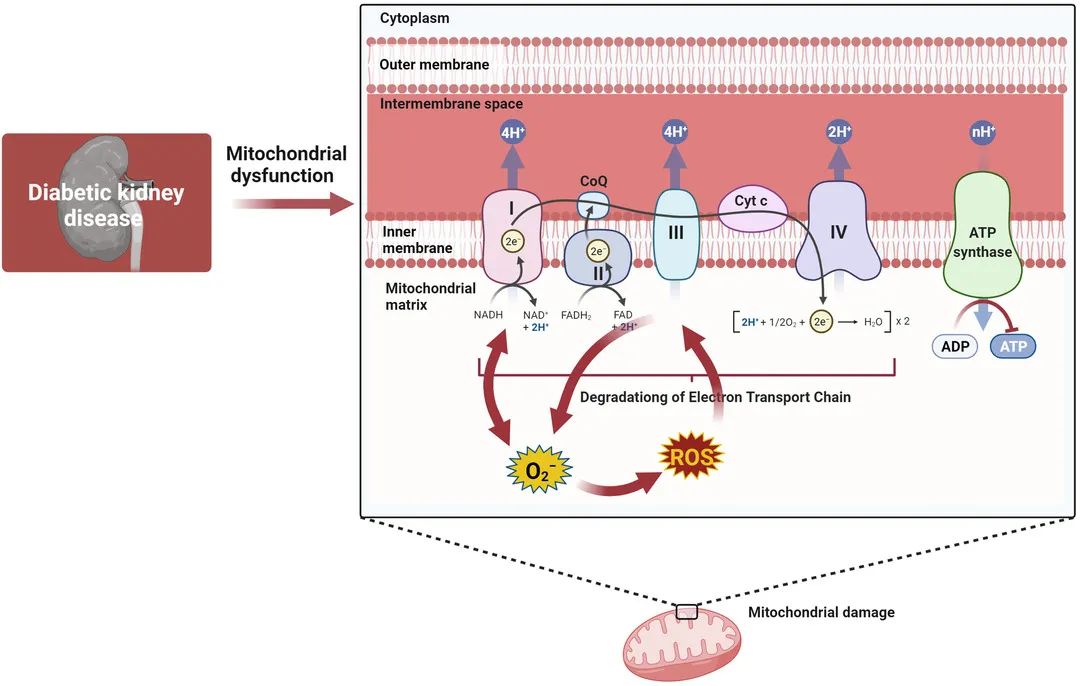
目前,主流观点认为线粒体自噬对CKD和DKD有肾脏保护作用,线粒体自噬的缺乏不仅与肾小管细胞衰老有关,还与肾脏疾病进展有关。然而,作为一个相当新的领域,该研究最令人困惑的发现是小管功能障碍中线粒体自噬失调的机制尚未确定。
总的来说,线粒体生物发生、氧化应激、线粒体自噬、线粒体动力学是多种质量控制机制,它们都对DKD中线粒体正常功能的调节具有集体影响或协同作用。不幸的是,关于它们相互作用的明确机制尚不完全清楚,需要进一步深入研究。
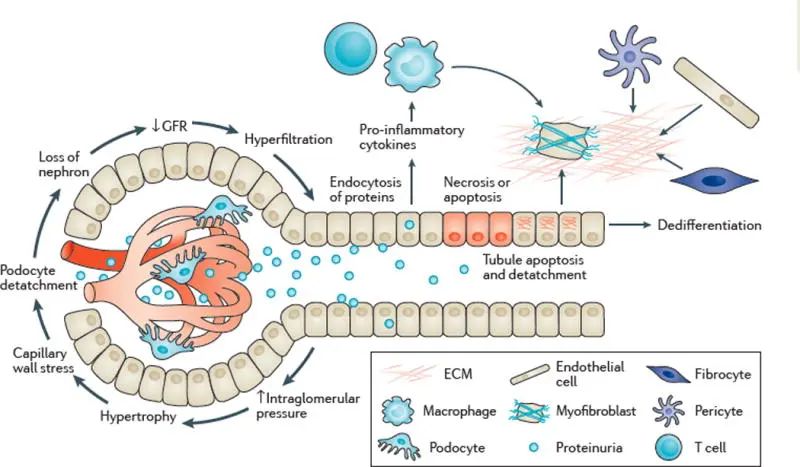
图3 肾纤维化发展历程示意图(Edeling et al., 2016)。
作为肾脏中的主要细胞群,肾小管在纤维化反应中起着核心作用(Bonventre JV. 2014)。同时,肾小管上皮细胞(TECs)又是肾脏在应对各种损伤时最脆弱的细胞,TECs受损后,通过调节其细胞凋亡与增殖,或通过产生促炎和促纤维化细胞因子参与肾纤维化的发病机制(Liu Y. 2011)。RF程度与肾功能损伤程度相关,并决定肾脏疾病的预后。
TECs中线粒体的完整性和功能受损与RF的进展密切相关。TECs作为肾脏的主要成分,容易受到各种刺激,例如缺氧、缺血、蛋白尿和毒素,而受损的TECs可释放与损伤相关的分子模式和促炎细胞因子,从而引发炎症。间质炎症反过来会加剧TECs损伤,形成放大环,导致进行性肾损伤和RF。
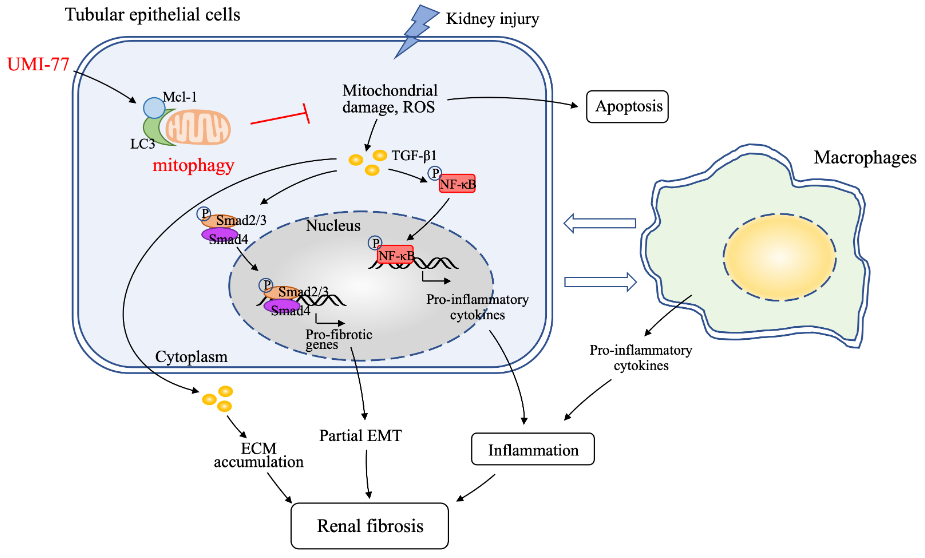
近日,发表在FASEB JOURNAL杂志上的“Mitophagy induced by UMI-77 preserves mitochondrial fitness in renal tubular epithelial cells and alleviates renal fibrosis”一文中,主要探讨了UMI-77(新型线粒体自噬诱导剂)对线粒体自噬激活的影响,通过使用UMI-77在TECs中诱导线粒体自噬,发现线粒体自噬的激活减轻了线粒体功能障碍,抑制了TGF-β1/Smad信号传导,并减弱了炎症,从而延缓了单侧输尿管梗阻(UUO)小鼠RF的发生发展(图4)。
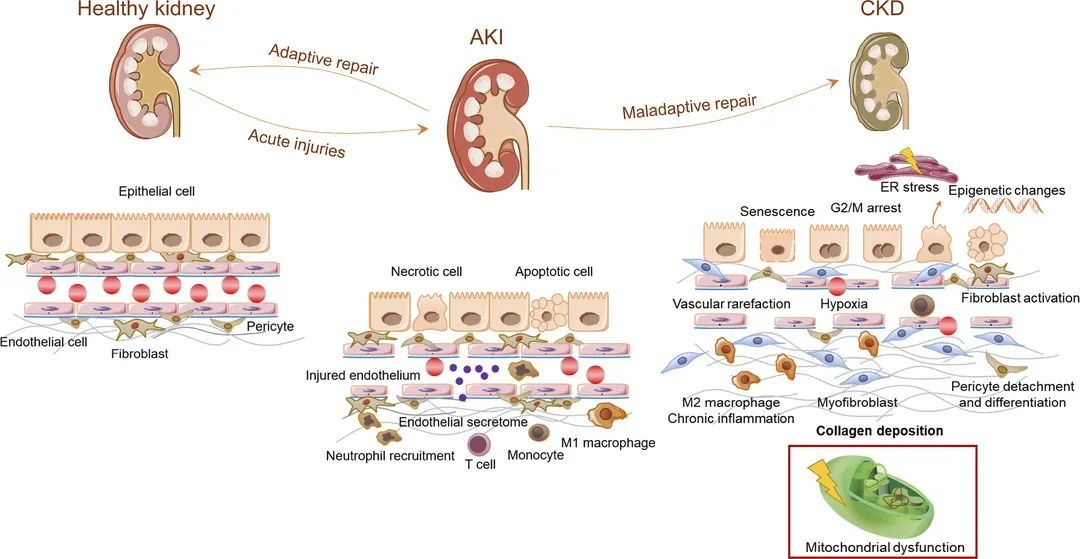
图5 参与AKI-CKD连续体的病理生理过程示意图(Jiang et al., 2020)。
近年来,线粒体自噬在AKI中的作用和调控也引起了广泛关注。首先,线粒体病理学发生在可检测到的肾功能损伤之前,并且持续存在于AKI后无法恢复的肾小管中;其次,肾功能损伤发作前的线粒体保护可预防AKI;再者,AKI后的线粒体保护减轻了向CKD的转变。
Ferenbach DA, Bonventre JV. Mechanisms of maladaptive repair after AKI leading to accelerated kidney ageing and CKD. Nat Rev Nephrol. 2015 May;11(5):264-76.
Jha V, Garcia-Garcia G, Iseki K, et al. Chronic kidney disease: global dimension and perspectives. Lancet. 2013;382(9888):260-272.
Jiang M, Bai M, Lei J, Xie Y, Xu S, Jia Z, Zhang A. Mitochondrial dysfunction and the AKI-to-CKD transition. Am J Physiol Renal Physiol. 2020 Dec 1;319(6):F1105-F1116.
Jin L, Yu B, Liu G, et al. Mitophagy induced by UMI-77 preserves mitochondrial fitness in renal tubular epithelial cells and alleviates renal fibrosis. FASEB J. 2022;36(6):e22342.
Liang X, Wang P, Chen B, et al. Glycogen synthase kinase 3β hyperactivity in urinary exfoliated cells predicts progression of diabetic kidney disease. Kidney Int. 2020;97(1):175-192.
Liu Y. Cellular and molecular mechanisms of renal fibrosis. Nat Rev Nephrol. 2011;7(12):684-696.
Wang Y, Cai J, Tang C, et al. Mitophagy in Acute Kidney Injury and Kidney Repair. Cells. 2020;9(2):338.
Yao L, Liang X, Qiao Y, et al. Mitochondrial dysfunction in diabetic tubulopathy. Metabolism. 2022;131:155195.
Zhang L, Long J, Jiang W, et al. Trends in Chronic Kidney Disease in China. N Engl J Med. 2016;375(9):905-906.