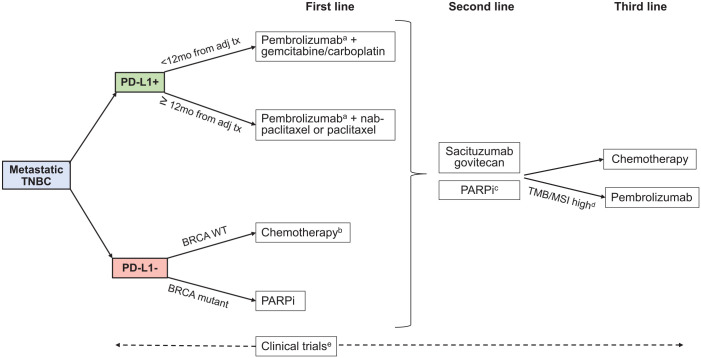
图1 目前已有的TNBC治疗策略(Huppert et al. 2022)。
世卫组织全球乳腺癌行动(GBCI)的目标是让全球乳腺癌死亡率每年下降2.5%,从而在2020至2040年期间在全球范围内减少乳腺癌死亡250万人。全球乳腺癌死亡率每年下降2.5%,到2030年乳腺癌死亡减少25%,到2040年70岁以下女性乳腺癌死亡率减少40%。实现这些目标的三大支柱是:早发现,促进健康;及时诊断;全面乳腺癌管理。综上,对于TNBC的治疗,目前仍亟需更多的有效治疗策略与理论依据。
TNBC与表观遗传调控
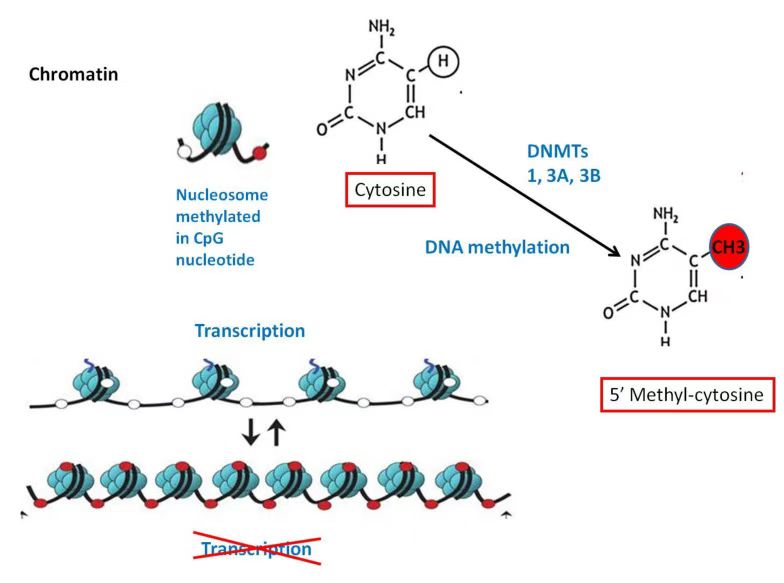
图2 DNA甲基化导致基因沉默示意图(Zolota et al., 2021)。
在真核细胞中,基因组DNA与组蛋白紧密结合,形成染色质。已有研究显示,赖氨酸甲基化已演变为与各种生物学功能有关的重要PTM,组蛋白赖氨酸甲基化可发生在组蛋白H3和H4的特定赖氨酸处,以激活或抑制转录,许多组蛋白/赖氨酸甲基转移酶可作为癌基因或肿瘤抑制因子来调节癌症的发生和进展(Shen H and Laird PW., 2013)。此外,非组蛋白的赖氨酸甲基化促进了它们与特定阅读器的相互作用,以进行下游信号传导,而赖氨酸甲基化与非组蛋白上的其他PTM之间的串扰会影响修饰蛋白的生物学功能。
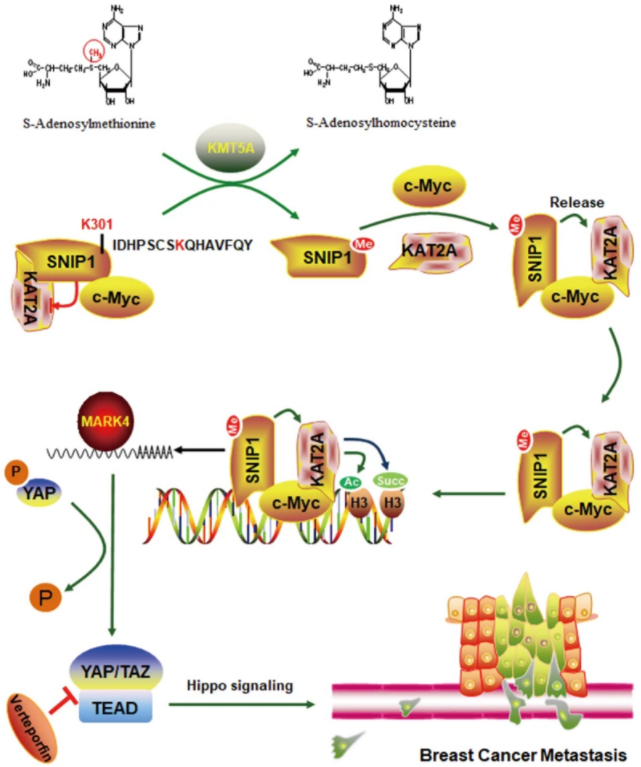
2022年4月21日,复旦大学附属肿瘤医院肿瘤内科胡夕春主任、张剑副主任联合兰州大学第一医院唐建明教授在Nature Communications(IF=14.919)上发表了题为“KMT5A-methylated SNIP1 promotes triple-negative breast cancer metastasis by activating YAP signaling”的研究论文。在本研究中,团队提出了一种KMT5A甲基化依赖性调节机制,从而调控SNIP1致癌功能。
详细而言,团队确定SNIP1是赖氨酸甲基转移酶KMT5A的非组蛋白底物,其经历KMT5A介导的单甲基化以促进乳腺癌细胞生长、侵袭和肺转移。机制上,KMT5A介导SNIP1的K301甲基化代表释放组蛋白乙酰转移酶KAT2A的传感信号,并促进c-MYC和KAT2A相互作用,以及c-MYC/KAT2A复合物对c-MYC靶标启动子的募集。该事件最终通过转录激活MARK4抑制Hippo/YAP信号通路,增强TNBC转移(图3)。
图3 KMT5A通过SNIP1甲基化状态促进Hippo/YAP信号通路修饰和TNBC转移示意图。
Liao M, Qin R, Huang W, et al. Targeting regulated cell death (RCD) with small-molecule compounds in triple-negative breast cancer: a revisited perspective from molecular mechanisms to targeted therapies. J Hematol Oncol. 2022;15(1):44.
Shen H, Laird PW. Interplay between the cancer genome and epigenome. Cell. 2013;153(1):38-55.
Yu B, Su J, Shi Q, et al. KMT5A-methylated SNIP1 promotes triple-negative breast cancer metastasis by activating YAP signaling. Nat Commun. 2022;13(1):2192.
Zolota V, Tzelepi V, Piperigkou Z, et al. Epigenetic Alterations in Triple-Negative Breast Cancer-The Critical Role of Extracellular Matrix. Cancers (Basel). 2021;13(4):713.