近年来,一些ncRNA在肿瘤相关Hh信号通路中调控蛋白编码基因的分子机制逐渐被阐明,表明ncRNA和Hh信号在癌症发病机制中的关键意义,为癌症的治愈和消除复发提供了线索。
因此,小医接下来将同大家一起探索在恶性肿瘤中显著异常表达的ncRNAs,研究其对Hh信号通路中的分子调控机制,尤其是circRNAs、miRNAs,寻找恶性肿瘤治疗的新希望。
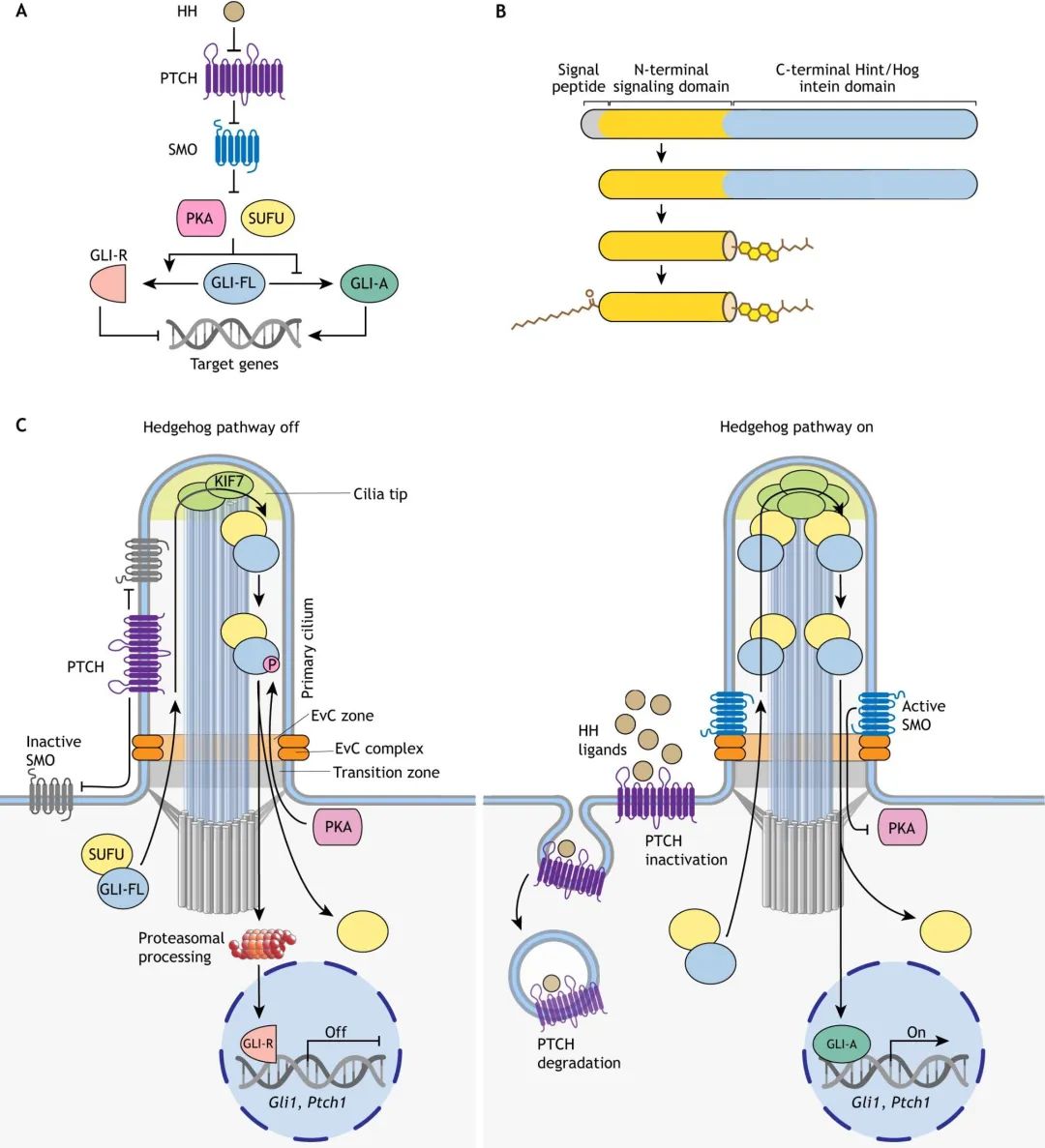
Hh基因家族参与了各种脊椎动物的神经系统、器官、软骨和性腺的形成,Hammerschmidt M等人对此进行了综述,感兴趣的的同学可自行对其进行学习哟。目前,已发现多种基因(如:Patched(PTCH)、Smoothened(SMO)、glioma-associated transcription factor(GLI)及Hh配体)参与Hh信号通路的转导(图1)。
图1 Hh信号通路概述(Kong et al., 2019)。(A)在没有Hh配体的情况下,PTCH抑制SMO活性,当SMO失活时,两种抑制成分:融合抑制因子(SUFU)和蛋白激酶A(PKA),分别通过直接结合和磷酸化抑制GLI转录因子家族的转录活性。(B)所有Hh配体在其C末端用胆固醇基团修饰,通过由C末端结构域催化的自蛋白水解反应连接,在其N末端用棕榈酰基团修饰,通过膜结合的O-酰基转移酶连接。(C)脊椎动物Hh信号与初级纤毛(PC)蛋白质运输事件有关。
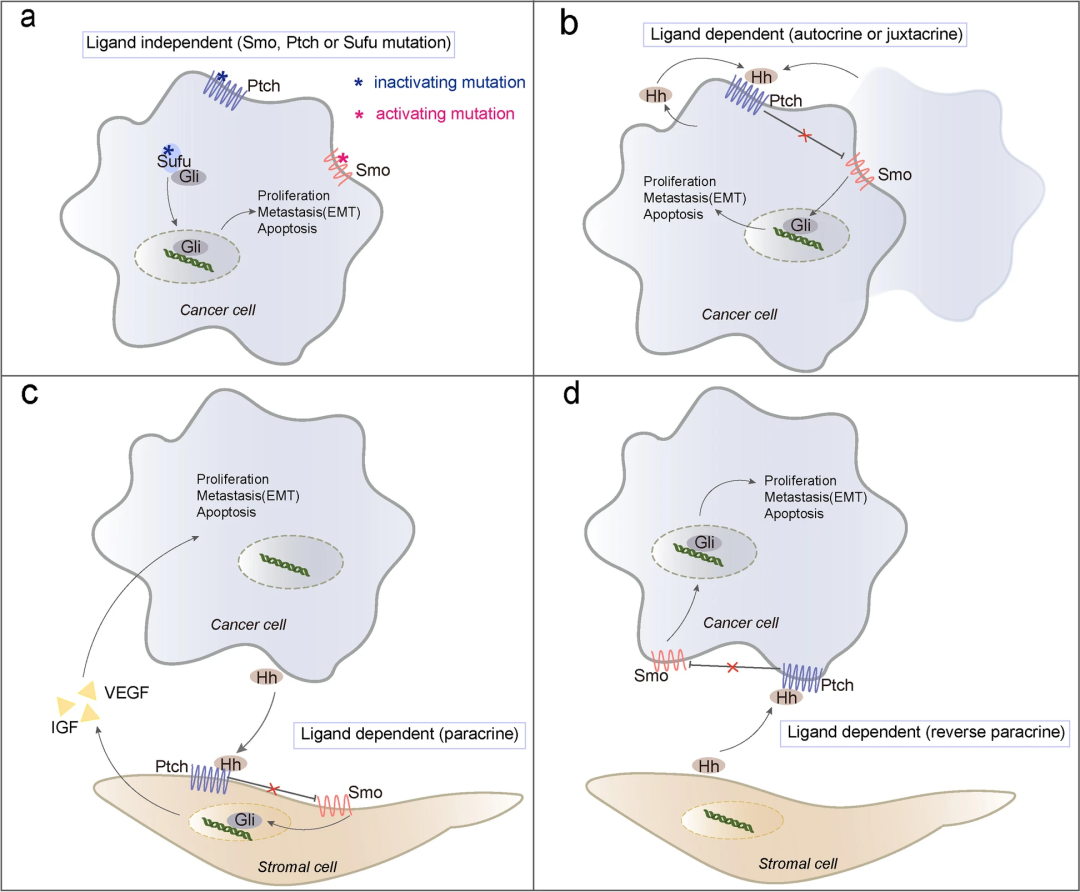
图2 肿瘤中异常Hh信号激活的三种模式(Song et al., 2022)。正负调节成分SMO和PTCH分别以红色和蓝色表示。(a)1型:不依赖配体的致癌Hh途径(自主型),分别由SMO或PTCH和SUFU基因中的激活或失活突变引起。(b)2型:配体依赖性致癌Hh途径(自分泌或并分泌型),肿瘤细胞自分泌Hh配体被相同肿瘤细胞(自分泌)或相邻肿瘤细胞(并列分泌)摄取,通过与SMO和PTCH相互作用,刺激恶性肿瘤Hh信号传导。(c)3/a型:配体依赖性致癌Hh途径(旁分泌),基质细胞摄取肿瘤细胞分泌的Hh配体后分泌一些生长因子,为肿瘤细胞生长提供适宜环境。(d)3/b型:配体依赖性致癌Hh途径(反向旁分泌),肿瘤细胞直接摄取基质细胞分泌的Hh配体的反向旁分泌模式,可触发Hh信号级联反应。
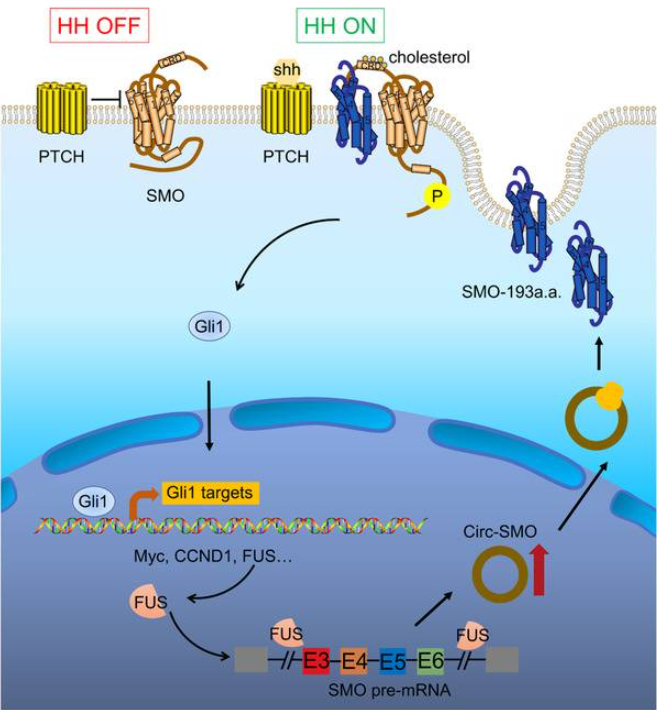
图3 本文图形摘要示意图(Wu et al., 2021)。
Kong JH, Siebold C, Rohatgi R. Biochemical mechanisms of vertebrate hedgehog signaling. Development. 2019;146(10):dev166892.
Liu Y, Song J, Liu Y, et al. Transcription activation of circ-STAT3 induced by Gli2 promotes the progression of hepatoblastoma via acting as a sponge for miR-29a/b/c-3p to upregulate STAT3/Gli2. J Exp Clin Cancer Res. 2020;39(1):101.
Nüsslein-Volhard C, Wieschaus E. Mutations affecting segment number and polarity in Drosophila. Nature. 1980;287(5785):795-801.
Song J, Ge Y, Sun X, et al. Noncoding RNAs related to the hedgehog pathway in cancer: clinical implications and future perspectives. Mol Cancer. 2022;21(1):115.
Wang YZ, Han JJ, Fan SQ, et al. miR-132 weakens proliferation and invasion of glioma cells via the inhibition of Gli1. Eur Rev Med Pharmacol Sci. 2018;22(7):1971-1978.
Wu X, Xiao S, Zhang M, et al. A novel protein encoded by circular SMO RNA is essential for Hedgehog signaling activation and glioblastoma tumorigenicity. Genome Biol. 2021;22(1):33.