作为临床医生,大家平时接触最多的无疑是患者的各种临床样本,即使没有病理组织,也一定会有外周血样。通常我们工作中会收集到许多不同分组的样本,比如早中晚期疾病组,治疗组,在做临床研究时,也会获得一些结果。但是每当做基础研究时,常常会迷失和迷茫,不知道应该如何选择课题方向和分类临床样本。今天为大家推荐的这篇发表于Science Advances(IF=14.136)的文章思路,就是利用临床随机对照开放标签实验中胰腺癌患者外周血和肿瘤组织样本,发现放疗联合化疗加靶向药物治疗时趋化因子CXCL8和自然杀伤(NK)细胞的变化,进而深入体内外研究,揭示放疗对于增强靶向治疗效果的机制。通过这篇文章,我们能够打开思路,了解如何根据临床样本选择课题方向,从而开展与临床紧密结合的基础研究,让我们一起来学习一下吧。
原文链接:https://www.science.org/doi/epdf/10.1126/sciadv.abh4050
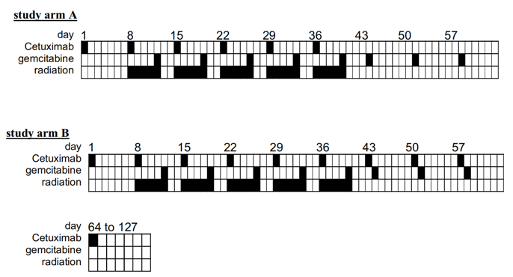
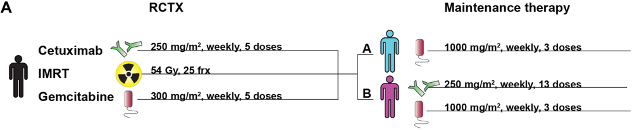
放化疗联合靶向或免疫治疗是现如今针对晚期肿瘤常用的治疗方法,并在一些实体瘤中取得了疗效。本文研究团队于2005-2008年期间进行了一项随机对照二期临床试验(ISRCTN56652283),66名局部晚期PDAC(胰腺癌)患者接受放疗联合西妥昔单抗+吉西他滨治疗,并在后续维持治疗中分为两组,一组是单纯吉西他滨治疗(对照),另一组是西妥昔单抗+吉西他滨治疗。具体情况如下图所示。
图片来源:https://bmccancer.biomedcentral.com/articles/10.1186/1471-2407-5-131
尽管对于胰腺癌这样KRAS高突变的实体瘤来说靶向EGFR的西妥昔单抗疗效不显著,但却可以作用于NK细胞,促进其杀伤肿瘤的作用。然而,目前面临的问题是实体瘤浸润的NK细胞数量较少,如何增强NK细胞的浸润是西妥昔单抗治疗胰腺癌的关键问题。本文就是在前期获得的临床试验结果基础上,揭示了放化疗联合西妥昔单抗增强NK细胞在胰腺癌肿瘤中浸润的机制。
Step 1:筛选目标分子,建立治疗效果与NK细胞的相关性
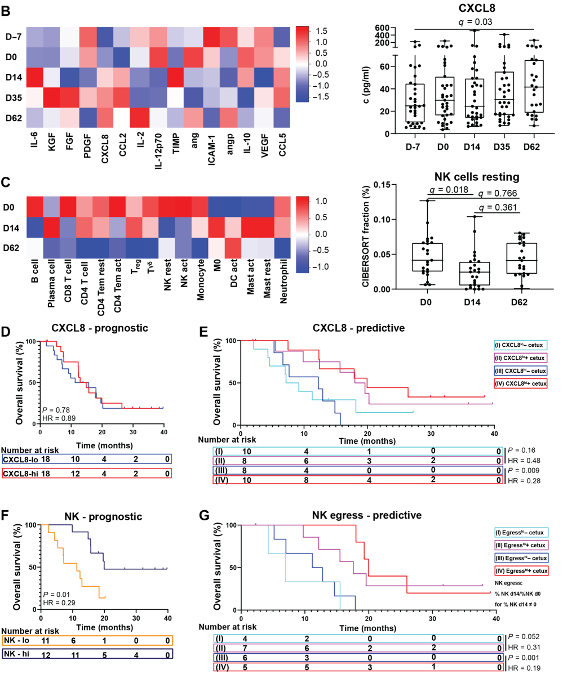
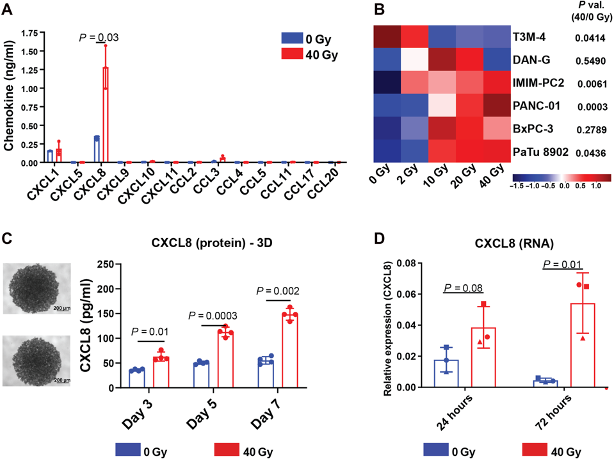
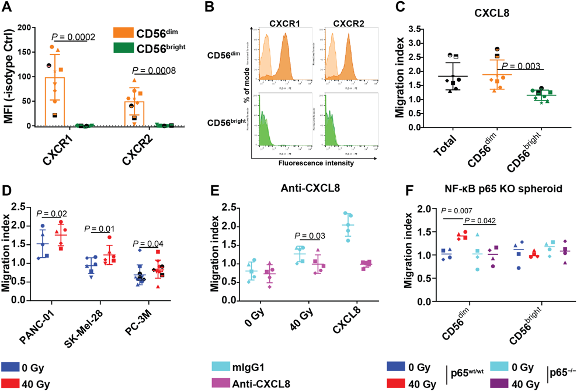
由于在治疗过程中能够获得的是外周血样本,因此作者分别在治疗前7天,治疗后0,14,35,62天分别收集两组患者的外周血样,并检测常见的细胞因子和趋化因子,发现只有CXCL8在治疗过程中持续升高,暗示CXCL8与放化疗联合西妥昔单抗治疗抗肿瘤的强相关性(B)。进一步鉴定外周血单核细胞占比,发现静息NK细胞在放疗阶段占比降低,尤其是CD56dim(高杀伤力)NK细胞变化明显(C)。对CXCL8外周血浓度和患者预后进行相关性分析,发现未进行联合治疗的患者预后未受到CXCL8浓度影响(D),但在维持期接受西妥昔单抗患者血清CXCL8浓度越高预后越好(E)。同时,在维持期接受西妥昔单抗患者的外周血NK细胞下降(浸润到肿瘤中)的比例较高,患者预后越好(F-G)。
这些结果均建立了CXCL8和NK细胞与放疗联合西妥昔单抗治疗效果的关系。
Step 2:肿瘤样本结合公共单细胞数据明确放疗对NK细胞浸润状态的作用
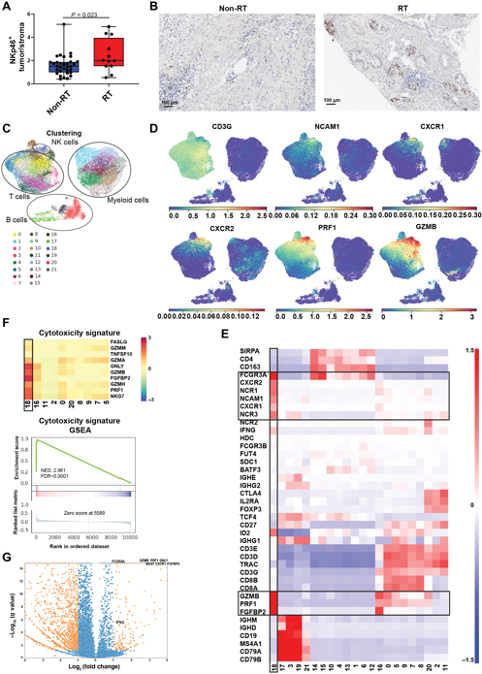
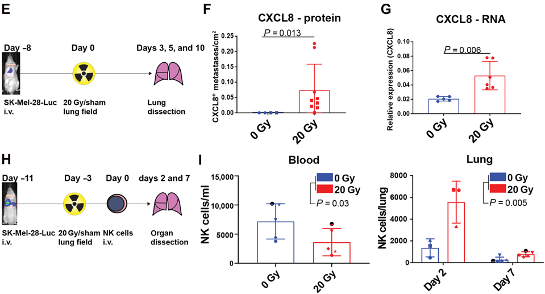
锁定目标分子和细胞类型后,就要验证NK细胞在PDAC组织内的浸润。作者首先检测NK细胞标志物NK p46+,发现接受放疗患者NK细胞肿瘤浸润更高(A-B)。进一步利用公共单细胞测序数据,经过细胞群鉴定、GSEA通路富集、NK细胞差异表达基因等分析,明确在经历放疗后CD56dim NK细胞在肿瘤中浸润更高,细胞毒性标志物和通路高表达,且高表达CXCL8受体CXCR1和CXCR2(C-E)。
Step 3:体内外功能实验阐明放疗诱导CXCL8表达
1)体外功能实验(常规操作)
通过对不同肿瘤细胞系(3种胰腺癌,1种黑色素瘤和1种前列腺癌)放疗照射前后细胞因子蛋白和转录水平的检测,在2D和3D维度同时证明放疗诱导肿瘤细胞表达CXCL8。
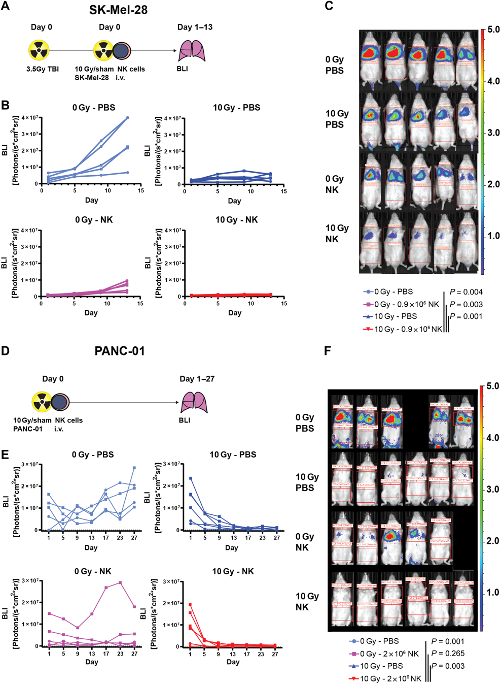
2)动物模型实验(肺部肿瘤模型)
作者同样使用了体内实验进行验证,构建小鼠肺部肿瘤模型。值得注意的是,这里使用的是人源化小鼠模型,使得人源肿瘤细胞系可以在小鼠肺部定植并表达CXCL8(小鼠细胞不表达CXCL8)。结果与体外实验一致,CXCL8在放疗后被诱导表达,对小鼠尾静脉注射NK细胞后得到与临床患者相一致的结果,即放疗后外周血NK细胞数量下降,肿瘤组织部位NK细胞增加。
Step 4:体外实验明确放疗诱导CXCL8的分子机制
1)衰老表型确定
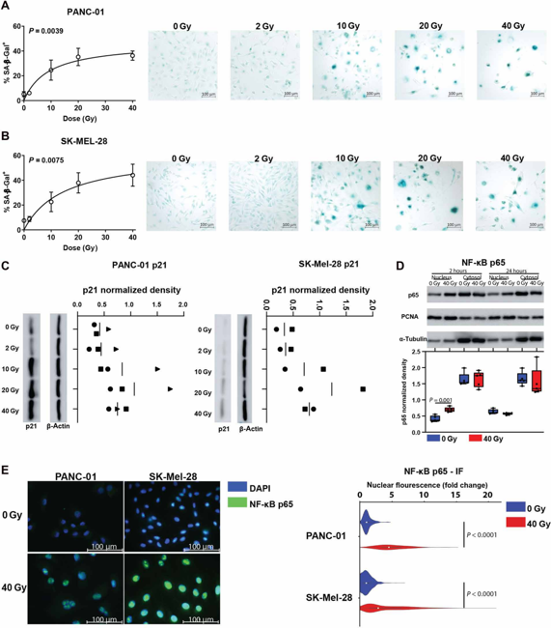
放疗杀伤细胞的主要原理为造成DNA损伤,而能够将DNA损伤与趋化因子表达分泌相连接的就是衰老和衰老相关分泌表型(SASP)。因此作者在体外检测了肿瘤细胞在放疗前后的衰老指标(SA-β-gal)和标志物(p21)的水平,提示均随着放疗显著提高(A-C)。NF-κB是SASP的主要调控通路,因此又检测了p65在放疗前后的表达和定位,显示放疗后p65的核定位增强,表明NF-κB通路激活。
2)通路验证
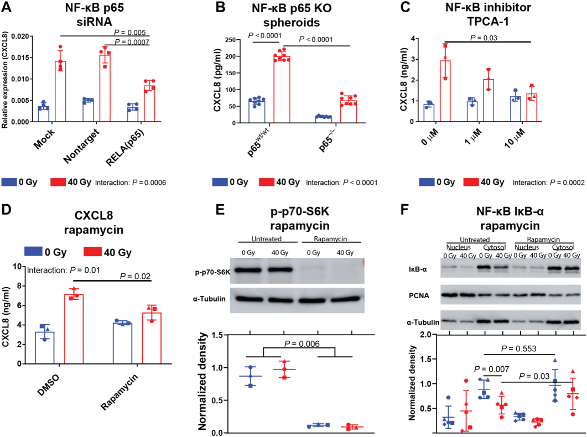
为了验证NF-κB是否为调控CXCL8表达的通路,作者在肿瘤细胞中敲减/敲除p65或使用NF-κB抑制剂,三者均显示干扰或敲除NF-κB能够降低放疗对CXCL8的诱导(A-C)。
由于mTOR也是著名的SASP诱导因子,因此使用mTOR抑制剂雷帕霉素处理肿瘤细胞,再次观察放疗前后CXCL8的表达和p65的定位,同样,CXCL8和NF-κB通路激活被阻断(D-F)。
Step 5:体外探究CXCL8对NK细胞肿瘤浸润的调控模式
为了将CXCL8和NK细胞肿瘤浸润相关联形成完整的调控链,作者将CD56dim和CD56brightNK细胞分离并检测CXCL8受体的表达,同时检测两种细胞在CXCL8处理以及放疗前后的迁移水平。结果证明CXCL8引导CD56dim NK细胞迁移,阻断CXCL8或NF-κB通路能消除这一迁移作用。
Step 6:动物模型体内证明放疗联合NK细胞过继转移阻断肿瘤生长
最后就是提升临床意义的动物体内实验。利用SK-Mel-28和PANC-01两种肿瘤细胞系以及NK细胞缺陷的人源化小鼠,将放疗辐照和尾静脉注射NK细胞联合,可以看到比起单独放疗肿瘤缩小程度大大提高,在PANC-01小鼠中肿瘤甚至几乎完全消失,表明联合疗法的重要优势。
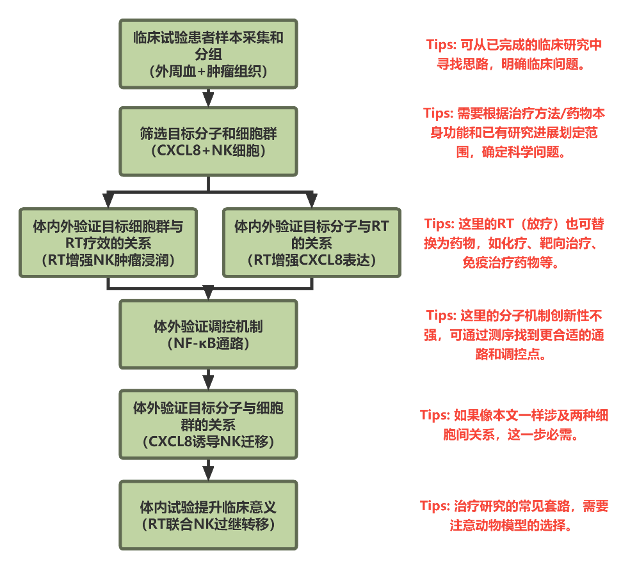
通用思路整理
总结
本文的重点部分无疑在于从前期临床试验的结果总结归纳出临床问题,进而提出RT使肿瘤细胞发生SASP分泌CXCL8,诱导NK细胞迁移浸润的科学问题。这一过程既需要对临床试验结果的深入分析,也需要合理的体内外预实验。文章中涉及的机制虽然不新,但好在整体的逻辑推导严谨,有理有据,层层深入,最后形成一个闭环,这对手握较多临床试验数据的医学研究者来说很有借鉴意义。
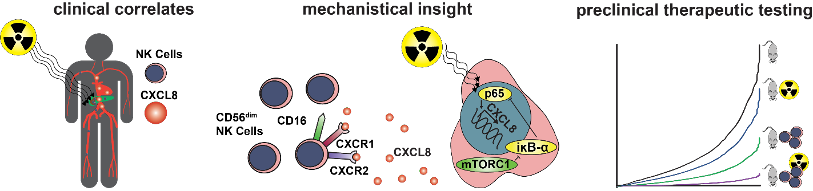
(本文机制图)
文章来源:小张聊科研